Лактатдегидрогеназа: механизм каталитической реакции
Механизм действия лактатадегидрогеназы (ЛДГ) можно представить на основе общих закономерностей ферментативного катализа, которые изложены на с. 96.
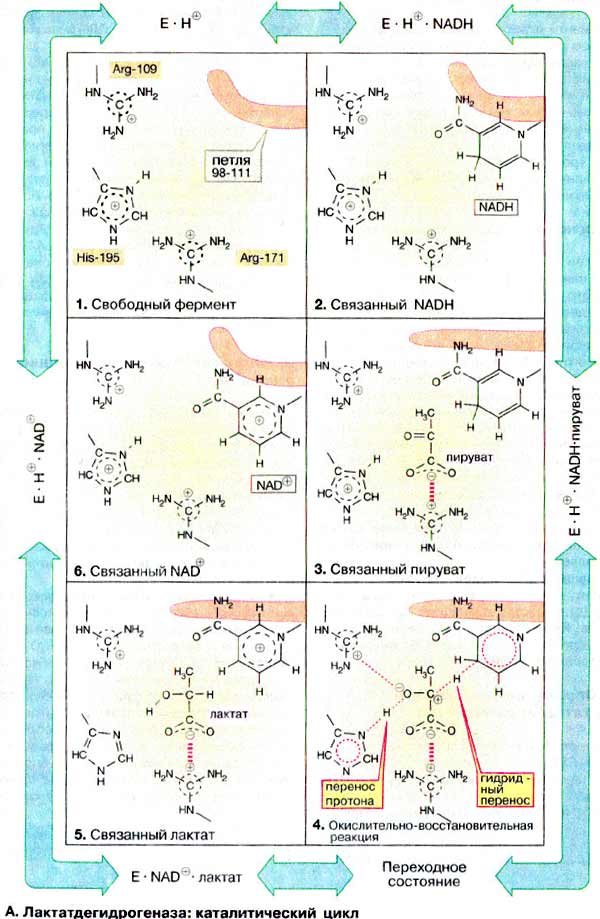
А. Лактатдегидрогеназа: каталитический цикл
ЛДГ катализирует передачу восстановительного эквивалента от лактата на НАД+ (NАD+) или от НАДН (NADH) на пируват.
L-лактат + НАД+ ↔ пируват + НАДН + H+
Равновесие реакции сдвинуто в сторону образования лактата (см. с. 24). Однако при высоких концентрациях лактата и НАД+ возможно окисление лактата в пируват. ЛДГ катализирует реакцию в обоих направлениях, но подобно всем ферментам не влияет на положение химического равновесия.
Из-за обратимости реакции каталитический процесс можно представить в виде движения по кругу. Каталитический цикл ЛДГ представлен на схеме в виде шести моментальных «снимков». Приведенные на схеме промежуточные стадии катализа очень кратковременны и поэтому строго не доказаны. Однако их существование подтверждается множеством экспериментальных данных
В активном центре ЛДГ принимают участие многие аминокислотные остатки. Они способствуют присоединению субстратов и кофермента или непосредственно участвуют в одной из стадий катализа. Здесь показаны лишь три особенно важные боковые цепи аминокислот: положительно заряженная гуанидиновая группа аргинина-171 связывает карбоксильную группу субстрата с помощью электростатического взаимодействия, имидазольная группа гистидина-195 принимает участие в кислотно-основном катализе, боковая цепь аргинина-109 важна для стабилизации переходного состояния. В противоположность His-195, меняющему свой заряд во время катализа, оба упомянутых остатка аргинина протонированы постоянно. Кроме этих трех остатков важную роль играет пептидная петля 98-111, показанная схематически (окрашена в малиновый цвет) на рис. 103. Ее функция состоит в том, чтобы после связывания субстрата и кофермента закрыть активный центр и исключить доступ молекул воды во время переноса электронов.
Рассмотрим теперь отдельные стадии катализируемого ЛДГ восстановления пирувата: в свободном ферменте (1) His-195 протонирован, в связи с чем эта форма обозначена как E ∙ H+ . Кофермент НАДН связывается первым (2), а за ним - пируват (3) Важно, что в молекуле фермента карбонильная группа пирувата и никотинамидное кольцо кофермента в активированном состоянии расположены друг относительно друга оптимально и такая ориентация фиксирована (сближение и ориентирование субстратов). Затем закрывается петля 98-111 над активным центром. Сильно пониженная полярность в области активного центра облегчает образование переходного состояния (4; доступ воды закрыт). В переходном состоянии гидрид-ион H- переносится с кофермента на карбонильный углерод (перенос группы). При этом временно образующийся энергетически невыгодный отрицательный заряд на кислороде стабилизируется электростатическим взаимодействием с Arg-109 (стабилизация переходного состояния). Одновременно осуществляется перенос протона с Нis-195 на атом кислорода (перенос группы), приводя к образованию связанных с ферментом лактата и НАД+ (5). После открытия петли лактат диссоциирует с фермента и временно незаряженная имидазольная группа Нis-195 снова присоединяет протон из окружающей воды (6). Наконец, освобождается также окисленный кофермент НАД+ и снова достигается исходное состояние (1). При окислении лактата в пируват протекают то же стадии, но в противоположном направлении
Входящий в уравнение реакции протон присоединяется не одновременно с NADH а после освобождения лактата, т. е. между стадиями (5) и (6) предшествующего цикла.


