Глутаматдегидрогеназа
ГЛУТАМАТДЕГИДРОГЕНАЗА, фермент, катализирующий взаимопревращение L-глутаминовой и 2-оксоглутаровой к-т: 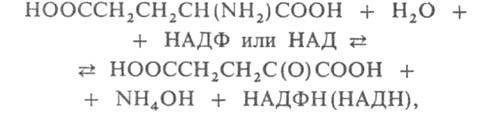
где НАДФ (НАД) и НАДФН (НАДН) соотв. окисленная и восстановленная форма кофермента никотинамидаденин-динуклеотидфосфата (никотинамидадениндинуклеотида) - акцепторы и переносчики электронов и водорода на промежут. стадиях. Относится к классу оксидоредуктаз.
Различают глутаматдегидрогеназы специфичные к НАД, НАД и НАДФ или только к НАДФ. Фермент имеет мол. м. 210-480 тыс. и обычно состоит из 4 или 6 одинаковых субъединиц. В активном центре содержатся остатки лизина, тирозина и ци-стеина. Третичная структура характеризуется наличием доменов с мол. м. 20 тыс. Известна первичная структура нескольких глутаматдегидрогеназ. Оптим. каталитич. активность при аминировании в области рН 7,5-8,5, при дезаминировании 8,5-9,5.
Глутаматдегидрогеназа содержится в животных, растениях и микроорганизмах. В бактериях и синезеленых водорослях представлена одной формой, в др. организмах - неск. изоферментами. Долгое время глутаматдегидрогеназы рассматривали как осн. фермент первичной ассимиляции NH3. Низкое сродство глутаматдегидрогеназы к NH4+, а также открытие глутаматсинтазы, обнаруженной во всех, кроме животных, организмах, свидетельствуют, что роль глутаматдегидрогеназы в ассимиляции NH3 незначительна.
Литература
Шатилов В. Р., "Успехи биологической химии", 1982, т. 23, с. 185-209; Fisher H.F., "Advances in Enzymology", 1973, v. 39, p. 369-417; Eisenberg H., Josephs R., Reisler E., "Advances in Protein Chemistry", 1976, v. 30, p. 101-81. А.В.Пушкин.
