Дыхательная цепь
Дыхательная цепь является частью процесса окислительного фосфорилирования. Компоненты дыхательной цепи катализируют перенос электронов от НАДН + Н+ или восстановленного убихинона (QH2) на молекулярный кислород. Из-за большой разности окислительно-восстановительных потенциалов донора (НАДН + Н+ и, соответственно, QH2) и акцептора (О2) реакция является высокоэкзергонической. Большая часть выделяющейся при этом энергии используется для создания градиента протонов (см. с. 128) и, наконец, для образования АТФ с помощью АТФ-синтазы.
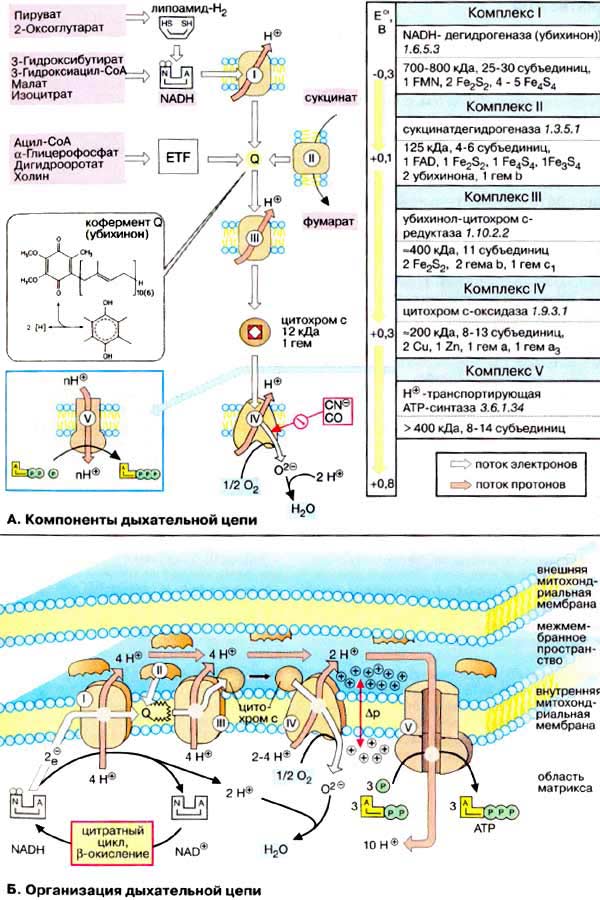
А. Компоненты дыхательной цепи
Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов.
Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками (см. сс. 108, 144). К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин, При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом.
Б. Организация дыхательной цепи
Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ.
Как уже упоминалось, все комплексы с I по V интегрированы во внутренней мембране митохондрий, тем не менее обычно они не контактируют друг с другом, так как электроны переносятся убихиноном и цитохромом с. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны.
Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ (ATP). Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство, откуда через порины проникает в цитоплазму.


