Убихиноны
УБИХИНОНЫ (коферменты Q; Qn, KoQn, 2,3-диме-токси-5-метил-6-полипренилбензохиноны, ф-ла I), желтые или желто-оранжевые кристаллы (при n = 7-15) или красные маслообразные в-ва (n=1-6), не раств. в воде, раств. в орг. р-рителях: 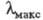 270-275 нм (в зависимости от р-ри-теля). В природе наиб, часто встречаются Q6 - Q10 с Е-конфигура-цией; организму человека свойствен Q10. Убихиноны играют важную роль в биоэнергетике клетки большинства прокариот и всех эукариот. Осн. ф-ция убихинонов- перенос электронов и протонов от разл. субстратов к цитохромам при дыхании и окислительном фосфорилировании.
270-275 нм (в зависимости от р-ри-теля). В природе наиб, часто встречаются Q6 - Q10 с Е-конфигура-цией; организму человека свойствен Q10. Убихиноны играют важную роль в биоэнергетике клетки большинства прокариот и всех эукариот. Осн. ф-ция убихинонов- перенос электронов и протонов от разл. субстратов к цитохромам при дыхании и окислительном фосфорилировании.
Убихиноны, гл. обр. в восстановленной форме (убихинолы, QnH2), выполняют ф-цию антиоксидантов. Убихиноны могут быть простетич. группой белков.
Выделены Q-связывающие белки трех классов, действующие в дыхат. цепи на участках функционирования ферментов сукцинату-бихинонредуктазы, НАДН-убихинонредуктазы и цитохромов в и с1.
Биосинтез убихинонов включает метаболич. превращения фенилала-нина, тирозина и др. в 4-гидроксибензойную к-ту (осн. предшественник ядра убихинонов), построение полипренилпирофосфатной цепи, перенос ее к 4-гидроксибензойной к-те (либо метаболитам норэпинефрина), последующие р-ции гидроксилирова-ния, О- и С-метилирования.
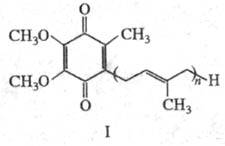
Существуют два осн. пути хим. синтеза убихинонов. Один из них включает алкилирование полипренильной цепью 2,3-диме-токси-5-метил-1,4-гидрохинона либо его моно- [R(R') = H, R'(R) = AIk, Ac] или диэфиров (R= R'= AIk, Ac) по р-ции Фриделя - Крафтса, а также регио- и стереоселективное пренилирование бензохинонового ядра:
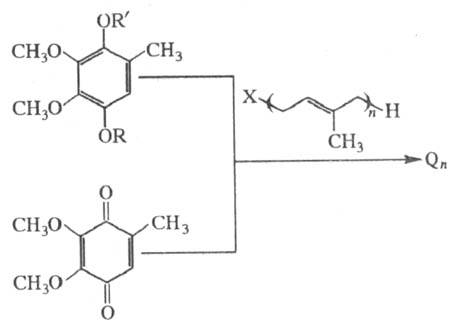
Стереоспецифич. синтез Q9 и Q10 можно осуществить на основе С45-изопреноидного спирта - соланезола и получаемого из него декапренола с участием алюмосиликатных катализаторов в р-ции алкилирования. Соланезол содержится в табаке и нек-рых др. растениях.
Второй подход к хим. синтезу убихинонов состоит в наращивании по терминальному звену полипренильной цепи низшего прир. гомолога или синтетического убихинона в окисленной форме либо в виде диэфира QnH2 на недостающий пренильныи фрагмент с помощью разл. р-ций С - С-сочетания:
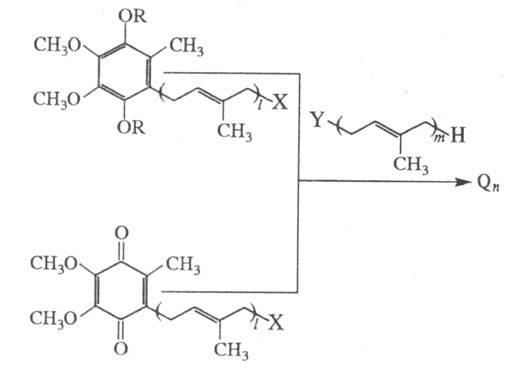
X=Cl, Br, C6H5SO2, CH3C6H4SO2; Y=CH3C6H4SO2, C6H5SO2, Br, Cl; R=AIk, Ac; l+т=п
Для пром. целей убихиноны целесообразно выделять из биомассы микроорганизмов (бактерии, дрожжи, грибы и др.); разработаны эффективные биотехнол. методы произ-ва Q9 и Q10.
Количественно убихиноны определяют спектрофотометрически по различию абсорбции-окисленной и восстановленной форм при 275 нм в р-ре этанола, методом высокоэффективной жидкостной хроматографии и др. методами; для идентификации гомологов убихинонов используют тонкослойную хроматографию с обращенной фазой, ЯМР и масс-спектрометрию. В УФ спектре для убихинонов характерно смещение максимума поглощения от 275 нм (этанол) к 290 нм при добавлении NaBH4 и изменение уд. показателя поглощения приблизительно в 3 раза.
Препараты убихинонов применяют для лечения заболеваний сердечно-сосудистой системы (в т. ч. хронических), лечения детей с митральным пороком сердца, для уменьшения кардиоток-сич. действия противоопухолевых антибиотиков и в качестве иммуномодулирующих ср-в.
Лит.: Обольникова E. А.,в кн.: Коферменты, под ред. В. А. Яковлева, M., 1973, с. 117-32; Коган Л.М., Обольникова Е.А., Самохвалов Г. И., "Хим.-фарм. журнал", 1983, т. 17, № 4, с. 410-20; Моисеен-ков A.M. [и др.], "Изв. АН СССР. Сер. хим.", 1989, № 7, с. 1612-15; Coenzyme Q., ed. by G. Lenaz, Chichester, 1985; Biomedical and clinical aspects of coenzyme Q, ed. by K. Folkers, Y. Yamamura, v. 1-5, Amst., 1977-86.
E. А. Обольникова.
