Окислительное фосфорилирование
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:
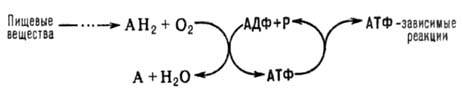
АН2-орг. в-ва, окисляемые в дыхат. цепи (т. наз. субстраты окисления, или дыхания), АДФ-аденозиндифосфат, Р-неорг. фосфат.
Поскольку АТФ необходим для осуществления мн. процессов, требующих затраты энергии (биосинтез, совершение мех. работы, транспорт в-в и др.), Окислительное фосфорилирование играет важнейшую роль в жизнедеятельности аэробных организмов. Образование АТФ в клетке происходит также благодаря др. процессам, напр. в ходе гликолиза и разл. типов брожения, протекающих без участия кислорода. Их вклад в синтез АТФ в условиях аэробного дыхания составляет незначит. часть от вклада окислительного фосфорилирования (ок. 5%).
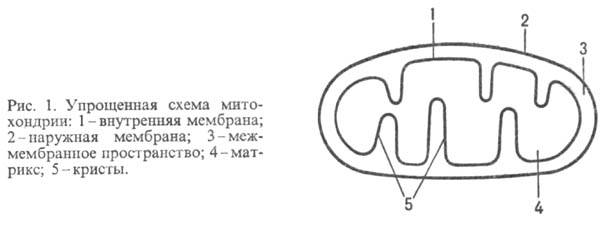
У животных, растений и грибов окислительное фосфорилирование протекает в спе-циализир. субклеточных структурах-митохондриях (рис. 1); у бактерий ферментные системы, осуществляющие этот процесс, находятся в клеточной мембране.
Митохондрии окружены белково-фосфолипидной мембраной. Внутри митохондрий (в т. наз. матриксе) идет ряд метаболич. процессов распада пищ. в-в, поставляющих субстраты окисления АН2 для окислительного фосфорилирования. Наиб. важные из этих процессов -трикарбоновых кислот цикл и т. наз.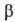 -окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться
-окисление жирных к-т (окислит. расщепление жирной к-ты с образованием ацетил-кофермента А и к-ты, содержащей на 2 атома С меньше, чем исходная; вновь образующаяся жирная к-та также может подвергаться 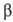 -окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии ферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) от субстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
-окислению). Интермедиаты этих процессов подвергаются дегидрированию (окислению) при участии ферментов дегидрогеназ; затем электроны передаются в дыхат. цепь митохондрий-ансамбль окислит.-восстановит. ферментов, встроенных во внутр. митохонд-риальную мембрану. Дыхат. цепь осуществляет многоступенчатый экзэргонич. перенос электронов (сопровождается уменьшением своб. энергии) от субстратов к кислороду, а высвобождающаяся энергия используется расположенным в той же мембране ферментом АТФ-синтетазой, для фос-форилирования АДФ до АТФ. В интактной (неповрежденной) митохондриальной мембране перенос электронов в дыхат. цепи и фосфорилирование тесно сопряжены между собой. Так, напр., выключение фосфорилирования по исчерпании АДФ либо неорг. фосфата сопровождается торможением дыхания (эффект дыхат. контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфори-лированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения).
Механизм окислительного фосфорилирования можно представить схемой: Перенос электронов (дыхание)  А ~ В
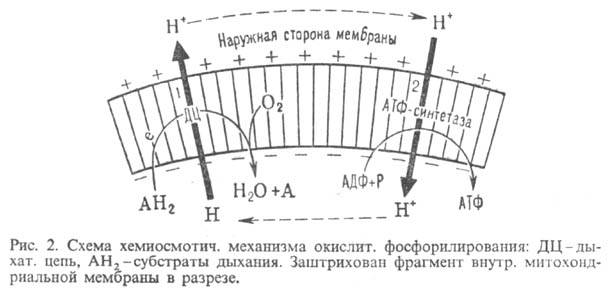
А ~ В АТФ А ~ В-высокоэнергетич. интермедиат Предполагалось, что А ~ В - хим. соед. с макроэргич. связью, напр. фосфорилир. фермент дыхат. цепи (хим. гипотеза сопряжения), или напряженная конформация к.-л. белка, участвующего в окислительном фосфорилировании (конформац. гипотеза сопряжения). Однако эти гипотезы не получили эксперим. подтверждения. Наиб. признанием пользуется хемиосмотич. концепция сопряжения, предложенная в 1961 П. Митчеллом (за развитие этой концепции в 1979 ему присуждена Нобелевская премия). Согласно этой теории, своб. энергия транспорта электронов в дыхат. цепи затрачивается на перенос из митохондрий через митохондриальную мембрану на ее наружную сторону ионов Н+ (рис. 2, процесс 1). В результате на мембране возникает разность электрич. потенциалов
АТФ А ~ В-высокоэнергетич. интермедиат Предполагалось, что А ~ В - хим. соед. с макроэргич. связью, напр. фосфорилир. фермент дыхат. цепи (хим. гипотеза сопряжения), или напряженная конформация к.-л. белка, участвующего в окислительном фосфорилировании (конформац. гипотеза сопряжения). Однако эти гипотезы не получили эксперим. подтверждения. Наиб. признанием пользуется хемиосмотич. концепция сопряжения, предложенная в 1961 П. Митчеллом (за развитие этой концепции в 1979 ему присуждена Нобелевская премия). Согласно этой теории, своб. энергия транспорта электронов в дыхат. цепи затрачивается на перенос из митохондрий через митохондриальную мембрану на ее наружную сторону ионов Н+ (рис. 2, процесс 1). В результате на мембране возникает разность электрич. потенциалов 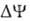 и разность хим. активностей ионов Н+
и разность хим. активностей ионов Н+ 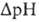 (внутри митохондрий рН выше, чем снаружи). В сумме эти компоненты дают трансмембранную разность электрохим. потенциалов ионов водорода
(внутри митохондрий рН выше, чем снаружи). В сумме эти компоненты дают трансмембранную разность электрохим. потенциалов ионов водорода 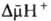 между матриксом митохондрий и внеш. водной фазой, разделенными мембраной:
между матриксом митохондрий и внеш. водной фазой, разделенными мембраной:
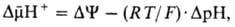
где R-универсальная газовая постоянная, T-абс. т-ра, F- число Фарадея. Величина 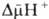 обычно составляет ок. 0,25 В, причем осн. часть (0,15-0,20 В) представлена электрич. составляющей
обычно составляет ок. 0,25 В, причем осн. часть (0,15-0,20 В) представлена электрич. составляющей 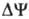 . Энергия
. Энергия 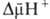 , выделяющаяся при движении протонов внутрь митохондрий по электрич. полю в сторону меньшей их концентрации (рис. 2, процесс 2), используется АТФ-синтетазой для синтеза АТФ. Т. обр., схему окислительного фосфорилирования, согласно этой концепции, можно представить в след. виде:
, выделяющаяся при движении протонов внутрь митохондрий по электрич. полю в сторону меньшей их концентрации (рис. 2, процесс 2), используется АТФ-синтетазой для синтеза АТФ. Т. обр., схему окислительного фосфорилирования, согласно этой концепции, можно представить в след. виде:
Перенос электронов (дыхание) 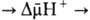 АТФ
АТФ
Сопряжение окисления и фосфорилирования через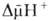 позволяет объяснить, почему окислительное фосфорилирование, в отличие от гликолитич. ("субстратного") фосфорилирования, протекающего в р-ре, возможно лишь в замкнутых мембранных структурах, а также почему все воздействия, снижающие электрич. сопротивление и увеличивающие протонную проводимость мембраны, подавляют ("разобщают") окислительное фосфорилирование. Энергия
позволяет объяснить, почему окислительное фосфорилирование, в отличие от гликолитич. ("субстратного") фосфорилирования, протекающего в р-ре, возможно лишь в замкнутых мембранных структурах, а также почему все воздействия, снижающие электрич. сопротивление и увеличивающие протонную проводимость мембраны, подавляют ("разобщают") окислительное фосфорилирование. Энергия 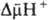 , помимо синтеза АТФ, может непосредственно использоваться клеткой для др. целей - транспорта метаболитов, движения (у бактерий), восстановления нико-тинамидных коферментов и др.
, помимо синтеза АТФ, может непосредственно использоваться клеткой для др. целей - транспорта метаболитов, движения (у бактерий), восстановления нико-тинамидных коферментов и др.
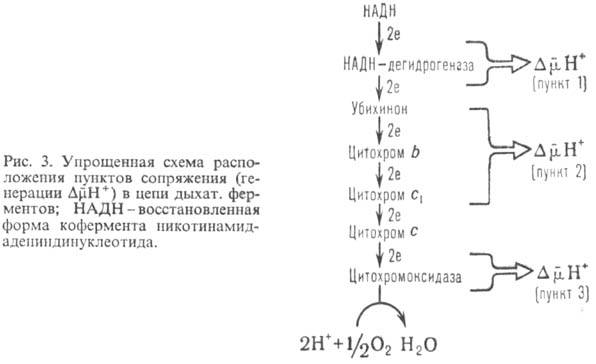
В дыхат. цепи имеется неск. участков, к-рые характеризуются значит. перепадом окислит.-восстановит. потенциала 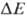 и сопряжены с запасанием энергии (генерацией
и сопряжены с запасанием энергии (генерацией 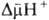 ). Таких участков, наз. пунктами или точками сопряжения, обычно три: НАДН: убихинон-редуктазное звено (
). Таких участков, наз. пунктами или точками сопряжения, обычно три: НАДН: убихинон-редуктазное звено (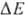 0,35-0,4 В), убихинол: цитохром-c-редуктазное звено (
0,35-0,4 В), убихинол: цитохром-c-редуктазное звено (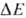 ~ ~ 0,25 В) и цитохром-с-оксидазный комплекс (
~ ~ 0,25 В) и цитохром-с-оксидазный комплекс (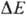 ~ 0,6 В)-пункты сопряжения 1, 2 и 3 соотв. (рис. 3). Каждый из пунктов сопряжения дыхат. цепи м.б. выделен из мембраны в виде индивидуального ферментного комплекса, обладающего окислит.-восстановит. активностью. Такой комплекс, встроенный в фосфолипидную мембрану, способен функционировать как протонный насос.
~ 0,6 В)-пункты сопряжения 1, 2 и 3 соотв. (рис. 3). Каждый из пунктов сопряжения дыхат. цепи м.б. выделен из мембраны в виде индивидуального ферментного комплекса, обладающего окислит.-восстановит. активностью. Такой комплекс, встроенный в фосфолипидную мембрану, способен функционировать как протонный насос.
Обычно для характеристики эффективности окислительного фосфорилирования используют величины Н+/2е или q/2e, указывающие сколько протонов (либо электрич. зарядов) переносится через мембрану при транспорте пары электронов через данный участок дыхат. цепи, а также отношение Н+/АТФ, показывающее, сколько протонов нужно перенести снаружи внутрь митохондрий через АТФ-синтетазу для синтеза 1 молекулы АТФ. Величина q/2e составляет для пунктов сопряжения 1, 2 и 3 соотв. 3-4, 2 и 4. Величина Н+/АТФ при синтезе АТФ внутри митохондрий равна 2; однако еще один Н+ может тратиться на вынос синтезированного АТФ4- из матрикса в цитоплазму переносчиком адениновых нуклеотидов в обмен на АДФ -3 . Поэтому кажущаяся величина Н+ / АТФнаружн равна 3.
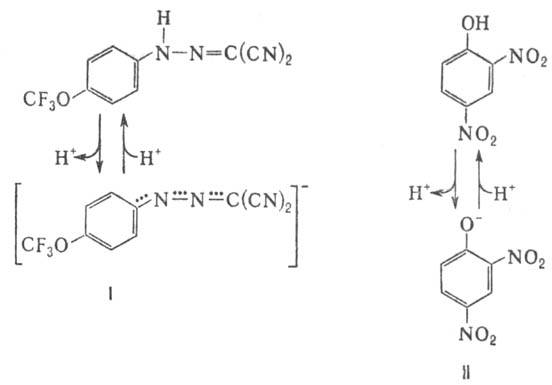
В организме окислительное фосфорилирование подавляется мн. токсичными в-вами, к-рые по месту их действия можно разделить на три группы: 1) ингибиторы дыхат. цепи, или т. наз. дыхат. яды (см. Дыхание). 2) Ингибиторы АТФ-синтетазы. Наиб. распространенные ингибиторы этого класса, употребляемые в лаб. исследованиях, - антибиотик олигомицин и модификатор карбоксильных групп белка дициклогексилкарбодиимид. 3) Т. наз. разобщители окислительного фосфорилирования. Они не подавляют ни перенос электронов, ни собственно фосфорилирование АДФ, но обладают способностью уменьшать величину 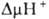 на мембране, благодаря чему нарушается энергетич. сопряжение между дыханием и синтезом АТФ. Разобщающее действие проявляет большое число соед. самой разнообразной хим. структуры. Классич. разобщители - в-ва, обладающие слабыми кислотными св-вами, способные проникать через мембрану как в ионизованной (депротонированной), так и в нейтральной (протонированной) формах. К таким в-вам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол, или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол (соотв. ф-лы I и II; показаны протонир. и депротонир. формы).
на мембране, благодаря чему нарушается энергетич. сопряжение между дыханием и синтезом АТФ. Разобщающее действие проявляет большое число соед. самой разнообразной хим. структуры. Классич. разобщители - в-ва, обладающие слабыми кислотными св-вами, способные проникать через мембрану как в ионизованной (депротонированной), так и в нейтральной (протонированной) формах. К таким в-вам относят, напр., 1-(2-дицианометилен)гидразино-4-трифтор-метоксибензол, или карбонилцианид-n-трифторметокси-фенилгидразон, и 2,4-динитрофенол (соотв. ф-лы I и II; показаны протонир. и депротонир. формы).
Двигаясь через мембрану в электрич. поле в ионизованной форме, разобщитель уменьшает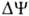 ; возвращаясь обратно в протонир. состоянии, разобщитель понижает
; возвращаясь обратно в протонир. состоянии, разобщитель понижает 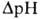 (рис. 4). Т. обр., такой "челночный" тип действия разобщителя приводит к уменьшению
(рис. 4). Т. обр., такой "челночный" тип действия разобщителя приводит к уменьшению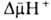
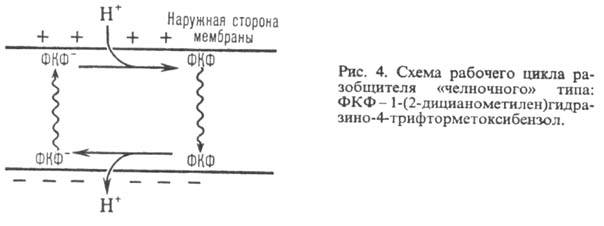
Разобщающим действием обладают также ионофоры (напр., грамицидин), повышающие электропроводность мембраны в результате образования ионных каналов или в-ва, разрушающие мембрану (напр., детергенты).
Окислительное фосфорилирование открыто В. А. Энгельгардтом в 1930 при работе с эритроцитами птиц. В 1939 В. А. Белицер и Е. Т. Цыбакова показали, что окислительное фосфорилирование сопряжено с переносом электронов в процессе дыхания; к такому же заключению несколько позднее пришел Г. М. Калькар.
Лит.: Рэкер Э., Биоэнергетические механизмы, пер. с англ., М., 1967; Ленинджер А., Основы биохимии, пер. с англ., т. 2, М., 1985, с. 508-46; Страйер Л., Биохимия, пер. с англ., т. 2, М., 1985, с. 71-94; Николc Д., Биоэнергетика. Введение в хемиосмотическую теорию, пер. с англ., М., 1985; Скулачев В. П., Энергетика биологических мембран, М., 1989.
А. А. Константинов.
