Цитохромы
ЦИТОХРОМЫ, сложные белки (гемопротеиды), содержащие в качестве простетич. группы гем. Служат переносчиками электронов в процессах внутриклеточного дыхания, окислит. фосфорилирования, фотосинтеза, ферментативного гидроксилирования и в др. биол. окислит.-восстановит. р-циях. Цитохромы найдены у всех животных, растений и микроорганизмов. Известно неск. десятков индивидуальных цитохромов, многие из к-рых выделены в гомогенном состоянии.
Все цитохромы ярко окрашены и имеют характерные спектры поглощения света в видимой области, меняющиеся при их окислении или восстановлении. В типичном спектре имеются три основные полосы поглощения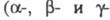 полосы в порядке убывания длин волн), по изменению к-рых обычно судят о степени восстановленности цитохрома.
полосы в порядке убывания длин волн), по изменению к-рых обычно судят о степени восстановленности цитохрома.
Донорами электронов для цитохромов обычно служат флавины, гидрохиноны, железо-серные белки или другие цитохромы; акцепторами - другие цитохромы или кислород (цитохромоксидазы). Нек-рые цитохромы (цитохромоксидаза, цитохром Р-450) прочно связаны с мембранами митохондрий, микросом (липопротеидные комплексы) и не раств. в воде, другие (напр., цитохром с) раств. в ней.
Цитохромы реагируют с лигандами, конкурирующими с естественным координац. окружением атома Fe гемов (СО, анионы азида, цианида и др.). Связывание этих лигандов приводит к изменению спектральных св-в и инактивации цитохромов.
Лит.: Диксон М., Уэбб Э., Ферменты, пер. с англ., т. 2, М., 1982, с. 692-713; Keilin D., The history of cell respiration and cytochrome, Camb., 1966.
А.Д. Виноградов.
