Трикарбоновых кислот цикл
ТРИКАРБОНОВЫХ КИСЛОТ ЦИКЛ (цикл Кребса), цик-лич. последовательность ферментативных р-ций (схема 1; назв. неионизир. форм к-т см. в ст. Обмен веществ), в к-рых осуществляются превращения ди- и трикарбоновых к-т, образующихся как промежут. продукты в организме животных, в растениях и микробах.
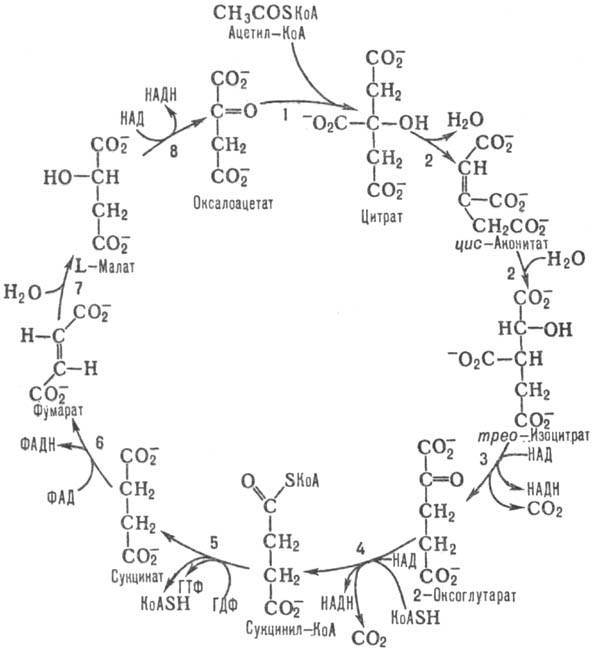
Схема 1. Цикл трикарбоновых к-т.
Одновременно трикарбоновых кислот цикл-метаболич. путь окисления до СО2 и Н2О аминокислот, жирных к-т и углеводов, к-рые вступают в этот цикл на разл. его стадиях (схема 2). Кроме того, образующиеся ди- и трикарбоновые к-ты м. б. исходными субстратами в биосинтезе мн. соед. (схема 3). Так, оксало-ацетат-субстрат в глюконеогепезе; сукцинил-КоА - проме-жут. продукт в синтезе порфиринов, ацетил-КоА-в синтезе жирных к-т, стероидов, ацетилхолина. Образующийся в цикле СО2 используется в р-циях карбоксилирования в синтезе жирных к-т, орнитиновом цикле и др. Участие трикарбоновых кислот цикла в биосинтезе и катаболизме мн. в-в обусловливает его важное место в обмене в-в.
Трикарбоновых кислот цикл широко распространен у всех аэробных организмов, у эукариот (все организмы, за исключением бактерий и синезеленых водорослей) он осуществляется в митохондриях.
Суммарная р-ция трикарбоновых кислот цикла у животных имеет вид:
CH3C(O)SKoA + 3НАД + ФАД + ГДФ + F + Н2О : : 2СО2 + 3НАДН + ФАДН + ГТФ + 2Н + KoASH
НАДН и НАД, ФАДН и ФАД-соотв. восстановленные и окисленные формы кофермента никотинамидадениндинук-леотида (см. Ниацин) и кофермента флавинадениндинуклео-тида (см. Рибофлавин); ГДФ и ГТФ-соотв. гуанозинди-и гуанозинтрифосфат, Ф-неорг. фосфат, KoASH-кофер-мент А.
НАДН и ФАДН, образующиеся в цикле, окисляются в цепи переноса электронов (см. Дыхание, Окислительное фосфорилирование) с образованием АТФ, к-рый играет важную роль в энергетич. обмене.
В р-ции 1 цикла, катализируемой цитрат - оксалоацетат-лиазой, CH3C(O)SKoA стереоспецифично конденсируется с карбонильной группой оксалоацетата с образованием цитрата и свободного KoASH. Р-ция сопровождается значит. изменением своб. энергии (DG0 — 32,24 кДж/моль) и является практически необратимой. Активность митохонд-риального фермента у дрожжей ингибируется АТФ.
Р-ция 2 цикла, катализируемая аконитат-гидратазой,-изомеризация цитрата в изоцитрат путем последоват. дегидратации - регидратации через промежут. образование цис-аконитата. Р-ция обратима, равновесие сдвинуто в сторону синтеза цитрата, однако в условиях непрерывного функционирования цикла конечным продуктом р-ции является изоцитрат.
В р-ции 3, катализируемой НАД- или НАДФ-зависимой изоцитратдегидрогеназой, происходит дегидрирование изо-цитрата при атоме С-2 с одновременным декарбоксили-рованием и образованием 2-оксоглутарата и СО2. Бактерии содержат НАДФ-зависимую изоцитратдегидрогеназу, активность к-рой регулируется хим. модификацией - фосфо-рилированием (инактивация) и дефосфорилированием (активация) при участии бифункцион. фермента изоцитратдегид-рогеназа-киназа (фосфатаза), играющего существ. роль в переключении обмена с трикарбоновых кислот цикла на анаплеротич. ("возмещающий" образование промежут. продуктов трикарбоновых кислот цикла) глиокси-латный цикл. Эукариоты содержат обе формы изоцитрат-дегидрогеназы. Активность НАДФ-зависимого фермента, локализованного в митохондриальном матриксе и цитозоле, контролируется продуктами р-ции. Активность НАД-зави-симой изоцитратдегидрогеназы, локализованной исключительно в митохондриальном матриксе, активируется у грибов аденозинмонофосфатом (АМФ) и цитратом, у животных - аденозиндифосфатом (АДФ), цитратом и ионами Са2+.
Р-ция 4 катализируется мультиферментным 2-оксоглута-ратдегидрогеназным комплексом, состоящим из трех осн. ферментов: 2-оксоглутаратдегидрогеназы, дигидролипоил-сукцинилтрансферазы и дигидролипоилдегидрогеназы.
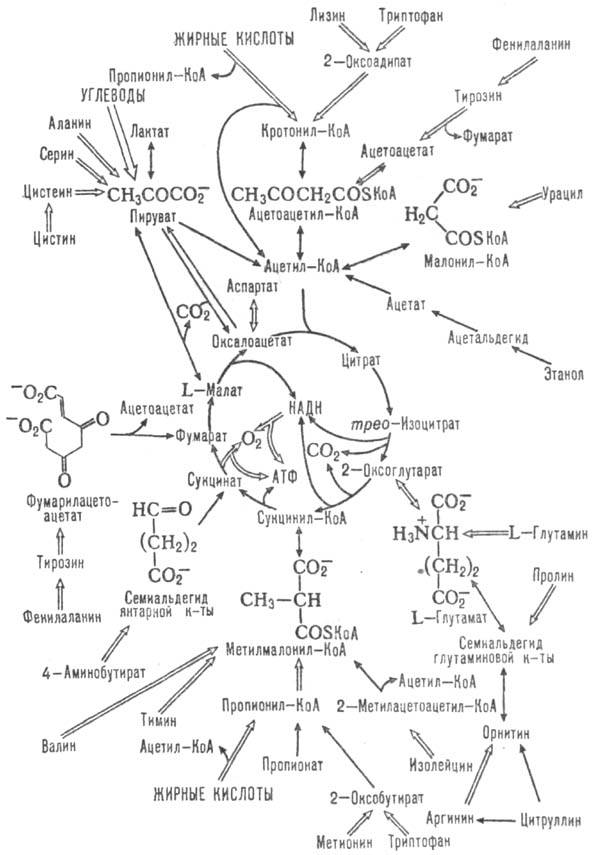
Схема 2. Цикл трикарбоновых к-т и катаболич. р-ции. Двойными стрелками отмечены многостадийные р-ции; семиальдегиды к-т w-оксокислоты.
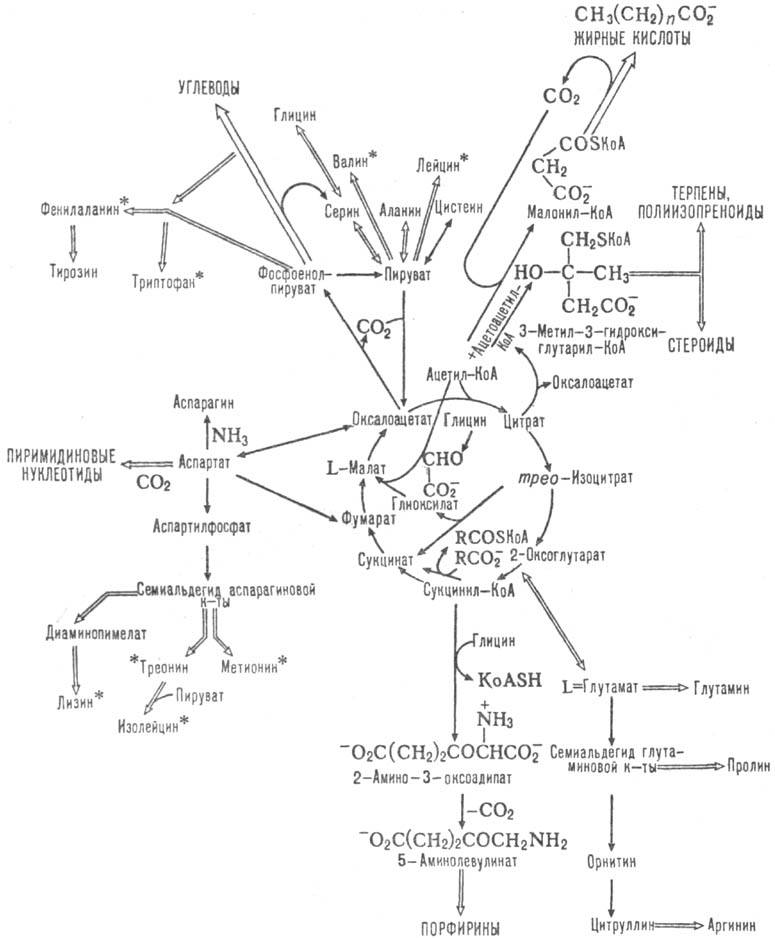
Схема 3. Биосинтетич. и др. р-ции, сопутствующие циклу трикарбоновых к-т; аминокислоты, отмеченные звездочкой, в организме высших животных несинтезирую гея.
Сукцинил-КоА в р-ции 5, катализируемой сукцинил-КоА -синтетазой, подвергается распаду, в результате к-рого энергия тиоэфирной связи сукцинил-КоА запасается в виде синтезир. нуклеозидтрифосфата (у бактерий, грибов, растений-АТФ, у животных - ГТФ).
В р-ции 6, катализируемой сукцинатдегидрогеназой, происходит превращение сукцината в фумарат. Фермент входит в состав более сложного сукцинатдегидрогеназного комплекса (комплекса II) дыхат. цепи, поставляя восстановит. эквиваленты, образующиеся в р-ции, в дыхат. цепь.
Фумарат-гидратаза, катализирующая р-цию 7, осуществляет гидратирование фумарата с образованием L-малата. Активность фермента ингибируется АТФ.
Последняя р-ция цикла, 8, катализируется L-малатдегид-рогеназой; L-малат при этом превращ. в оксалоацетат, к-рый может взаимод. с новой молекулой ацетил-КоА. Р-ция обратима, равновесие сдвинуто в сторону образования L-малата (DG0 +29,73 кДж/моль), но в условиях функционирования цикла конечным продуктом р-ции является оксалоацетат.
Предполагают, что катализируемые индивидуальными ферментами р-ции осуществляются благодаря действию надмолекулярного "сверхкомплекса", т. наз. метаболона. Преимущества такой организации ферментов очевидны -при этом не происходит диффузии кофакторов и субстратов, что способствует более эффективной работе цикла.
Наличие в трикарбоновых кислот цикле 4 восстановит. р-ций (3, 4, 6 и 8), в результате к-рых на 1 молекулу CH3C(O)SKoA синтезируются 3 молекулы НАДН и 1 молекула ФАДН, определяет необходимые условия для его функционирования. Непрерывная работа цикла требует реокисления НАДН и ФАДН, к-рое в аэробных условиях, как правило, осуществляется через совокупность переносчиков электронов, составляющих дыхат. цепь, и сопровождается запасанием значит. кол-ва энергии. У животных это 11 молекул АТФ на 1 молекулу окисленного ацетил-КоА. У грибов, растений и особенно бактерий число молекул АТФ, образующихся при окислении НАДН и ФАДН, м.б. меньше вследствие разветвления дыхат. цепи.
В анаэробных условиях вместо трикарбоновых кислот цикла функционируют его окислит. ветвь до 2-оксоглутарата (р-ции 1 : 2 : 3) и восстановительная - от оксалоацетата до сукцината (р-ции 8 : 7 : 6). При этом не происходит запасания большого кол-ва энергии и ф-ция цикла целиком определяется доставкой в-в для синтеза клеточного материала.
При переходе организма от покоя к активному состоянию возникает потребность в ускоренной мобилизации энергии (обменных процессов). У животных это достигается, в частности, шунтированием наиб. медленных р-ций трикарбоновых кислот цикла (р-ции 1-3) и преимуществ. окислением сукцината. При этом исходный субстрат укороченного трикарбоновых кислот цикла (2-оксоглутарат) образуется в результате быстрой р-ции переаминирования:
Глутамат + Оксалоацетат 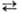 2-Оксоглутарат + Аспартат
2-Оксоглутарат + Аспартат
Связь трикарбоновых кислот цикла с глиоксилатным циклом осуществляется благодаря синтезу в последнем сукцината, к-рый в трикарбоновых кислот цикле окисляется до оксалоацетата и служит, т. обр., поставщиком молекул с 4 атомами С в оба цикла на начальных стадиях их функционирования. Благодаря этому возможно функционирование этих циклов, когда в организме избыток соед. с 2 атомами С, напр. при выращивании бактерий на средах с СН3СООН и С2Н5ОН, а также при прорастании семян масличных растений, во время к-рого усиленно образуется ацетил-КоА.
Др. модификация трикарбоновых кислот цикла (т. наз. 4-аминобутиратный шунт) - превращение 2-оксоглутарата в сукцинат, через глу-таминовую к-ту, 4-аминобутират и янтарный семиальдегид (3-формилпропионовая к-та). Эта модификация имеет большое значение для ткани мозга, в к-рой ок. 10% глюкозы распадается по этому пути.
Тесное сопряжение р-ций трикарбоновых кислот цикла с дыхат. цепью, особенно в митохондриях животных, а также особенности регуляции активности индивидуальных ферментов цикла (для большинства из них АТФ является ингибитором) предопределяют снижение активности цикла в условиях генерирования высокого фосфорильного потенциала (отношения АТФ/АДФ) в клетке, и наоборот - активацию цикла при пониж. фосфорильном потенциале. У большинства растений, бактерий и мн. видов грибов тесное сопряжение цикла с дыхат. цепью преодолевается развитием альтернативных несопряженных путей окисления, позволяющих поддерживать дыхат. активность и активность трикарбоновых кислот цикла на высоком уровне даже в условиях высокого фосфорильного потенциала. Трикарбоновых кислот цикл открыт в 1937 X. Кребсом и У. Джонсоном.
Лит.: Страйер Л., Биохимия, пер. с англ., т. 2, М., 1985, с. 49-68; Ленинджер А., Основы биохимии, пер. с англ., т. 2, М., 1985, с. 477-507; Кондрашова М.Н., "Биохимия", 1991, т. 56, в. 3, с. 388-404; Krebs H. А., Kornberg H. L., Energy transformations in living matter, В., 1957; Krebs H. А., "Persp. Biol. Med.", 1970, v. 14, p. 154-70; Srere P. A., "Ann. Rev. Biochem.", 1987, v. 56, p. 89-124. P. А. Звягильская.
