Оксинафтохиноны
ОКСИНАФТОХИНОНЫ (гидроксинафтохиноны), производные нафтохинонов, содержащие в молекуле одну или неск. гидроксильных групп.
Все оксинафтохиноны-кристаллы от желтого до темно-красного цвета (см. табл.); хорошо раств. в полярных орг. р-рителях (особенно моногидроксипроизводные ф-л I и II) и водных р-рах щелочей. Нек-рые оксинафтохиноны нестабильны и не имеют четких т-р плавления, поэтому их идентифицируют в виде ацетильных или алкоксильных производных, а также продуктов р-ции с 1,2-фенилендиамином - феназинов.
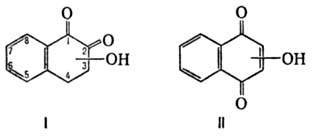
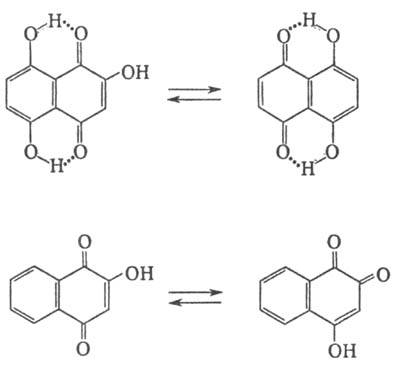
Оксинафтохиноны, содержащие гидроксигруппы в сопряженном арома-тич. ядре, обладают св-вами фенолов и нафтохинонов. Оксинафтохиноны, имеющие гидроксигруппы в положениях 5 или 8, проявляют пери-таутомерию вследствие образования прочной водородной связи, оксинафтохиноны с гидроксильными группами в хиноидной системе - орто-пара-таутомерию:
2-Гидрокси-1,4-нафтохинон-к-та, рКа 4,0 (25 °С, вода); в р-рах изомеризуется в 4-гидрокси-1,2-нафтохинон. Под действием СН3I, С2Н5I или С4Н9I превращ. в 4-алкокси-1,2-нафтохиноны с примесью 2-алкокси-1,4-нафтохинонов, под действием (СН3)2СНI, СН3ОН (в 3%-ном р-ре НСl) или CH2N2- в соответствующие 2-алкокси-1,4-нафтохиноны. При нагр. с тетрадециламином (кат.-HCl) замещает гид-роксил на аминогруппу с образованием 2-тетрадецилами-но-1,4-нафтохинона; вступает в р-цию Манниха; по положению 3 нитруется смесью HNO3 и H2SO4, галогенирует-ся в присут. СН3СООН, реагирует с солями арилдиа-зония; вступает в диеновый синтез с 1,3-бутадиеном (С2Н5ОН, 135-140 °С); окисляется О2 в присут. КОН в антрахинон.
5-Гидрокси-1,4-нафтохинон легко раств. в СНСl3, разб. р-рах щелочей, плохо-в холодном этаноле, диэтиловом эфире. По хим. св-вам аналогичен 1,4-нафтохинону; присоединяет галогены по положениям 2 и 3, окисляется щелочным р-ром Н2О2 в 3-гидроксифталевую к-ту.
6-Гидрокси-1,4-нафтохинон нитруется 66%-ной HNO3 в СН3СООН до 5-нитропроизводного, присоединяет Вr2 в СН3СООН по положениям 2 и 3.
Выделяют 2-гидрокси-1,4-нафтохинон из листьев лавсо-нии (Lawsonia alba) действием р-ра соды (60 °С) с послед. подкислением НСl. Пром. методы получения: окисление пероксидом водорода 1-нафтола (кат.-ортованадаты щелочных металлов) или 1,2-нафтохинона (в р-ре КОН); окисление действием О2 воздуха 1,3-дигидроксинафталина (кат.-КОН); окисление 2-нафтола системой СН3ОН-мор-фолин-соль Сu (II).
5-Гидрокси-1,4-нафтохинон выделяют из зеленой скорлупы грецких орехов Juglaus regia; синтезируют окислением 1,5-дигидроксинафталина дихроматом Na в H2SO4.
СВОЙСТВА НЕКОТОРЫХ ГИДРОКСИНАФТОХИНОНОВ
| Положения групп ОН в ядре | Тривиальное назв. | Мол. м. | Т.пл., °С | Т.пл. нек-рых производных, | ||
| | Моногидрокси-1, 2-нафтохиноны | |||||
| 3 | | 174,2 | 263-265 | - | ||
| 5 | - | То же | 178-180 | - | ||
| б | - | — "— | 165 (с разл.) | 288-289 (феназин) | ||
| 7 | - | — "— | 203-204 | 293 (феназин) | ||
| | Моногидрокси-1,4-нафтохиноны | |||||
| 2 | Лавсон (нафталиновая к-та)* | 174,2 | 195-196 | - | ||
| 5 | Юглон | То же | 153-154 | _ | ||
| 6 | - | -"- | 170 (с разл.) | 102 (ацетильное производное) | ||
| | Дигидрокси-1,4-нафтохиноны | |||||
| 2,3 | Изонафтаза-рин | 190,2 | 287 | 105-106 (диацетильное производное) | ||
| 2,5 | Гидрокси-юглон | То же | 220 | - | ||
| 2,6 | - | -"- | 100 (с разл.) | 163 (диацетильное производное) | ||
| 2,7 | - | — "— | 205-210 (с разл.) | - | ||
| 2,8 | - | -"— | 218-220 | 152 (диацетильное производное) | ||
| 5; 6 | 0-Нафтазарин | -"- | 180-183 | 152 (с разл.; диацетильное производное) | ||
| 5,7 | - | -"- | 165-170 | 126-127 (диацетильное производное) | ||
| 5,8 | Нафтазарин** | -"- | 276-280 | 195-196 (диацетильное производное) | ||
| 6,7 | - | -"- | - | 65-67 (диацетильное производное) | ||
| | Полигидрокси-1,4-нафтохиноны | |||||
| 2,3,6 | - | 206,2 | 300 | 116 (триметиловый эфир) | ||
| 5,6,8 | Нафтопурпу-рин*** | То же | 222 | 165-166 (триацетильное производное) | ||
| 2,3,5,8 | Синизарин | 222,2 | 265 | - | ||
| 2,3,5,7 | Спинохром Б | То же | 350-355 | 157 (тетраацетильное производное) | ||
| 2,3,5,6,8 | Спинохром Д | 254,2 | 285-290 (с возг.) | | ||
* рКа 4,00 (25°С, вода). ** pKa1 8,2, рКa2 10,6 (20°С, вода), 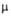 1,60·10-30 Кл·м. *** рКа 5,80 (20 °С, вода).
1,60·10-30 Кл·м. *** рКа 5,80 (20 °С, вода).
4-,5-,6-,7-Гидрокси-1,2-нафтохиноны, 5- и 6-гидрокси-1,4-нафтохиноны получают также окислением соотв. 1,3-, 1,5-, 2,6-, 1,2-, 1,8- и 1,6-дигидроксинафтохинонов солью Фреми [(KOSO2)2NO] или окислением соответствующих амино-нафталиндиолов Na2Cr2O7 в H2SO4 (0 °С) или РеСl3 в разб. НСl (20 °С).
2,3-Дигидрокси-1,4-нафтохинон получают окислением 1,2-нафтохинона НСlО в воде; 5,8-дигидрокси-1,4-нафтохи-нон - конденсацией гидрохинона с малеиновым ангидридом при 200-220 °С (кат.-плав АlСl3 с NaCl).
5,6,8-Тригидрокси-1,4-нафтохинон синтезируют взаимод. 1,2,4-триметоксибензола с малеиновым ангидридом при 200-250 °С (кат.-АlСl3) или окислением 5,6-дигидрокси-1,4-нафтохинона О2 воздуха в водном р-ре NaOH.
Оксинафтохиноны-сильные окислители; окислит.-восстановит, потенциал для 2-метокси-1,4-нафтохинона составляет 0,353 В, для 2-гидрокси-1,4-нафтохинона 0,362 В, для 5-гидрокси-1,4-наф-тохинона 0,452 В, для 2,3-дигидрокси-1,4-нафтохинона 0,298 В, для 5,8-дигидрокси-1,4-нафтохинона 0,256 В.
Оксинафтохиноны-промежут. продукты в синтезе кубовых красителей, окислители; 2-гидрокси-1,4-нафтохинон-красящее в-во хны, используемой в косметике; 5-гидрокси-1,4-нафтохинон-прир. краситель для шерсти и хлопка, фунгицид, компонент кожных мазей в медицине и ветеринарии; 2-алкил-З-гидро-кси-1,4-нафтохиноны- антималярийные препараты и инсектициды; 5,8-Дигидрокси-1,4-нафтохинон и 5,7,8-тригидро-кси-1,4-нафтохиноны-реактивы для фотометрич. определения Be и Th.
Лит. см. при ст. Нафтохиноны. Н. Б. Карпова.
