Натрия фосфаты
НАТРИЯ ФОСФАТЫ, ортофосфаты, пирофосфаты (дифос-фаты) и конденсир. фосфаты натрия. Кристаллич. или стеклообразные в-ва, хорошо раств. в воде, образуют кристаллогидраты (см. табл. 1,2). О р т о ф о с ф а т Na3PO4, д и г и д р о о р т о ф о с ф а т NaH2PO4 и г и д р о о р т о ф о с ф а т Na2HPO4 получают взаимод. Н3РО4 с Na2CO3 или NaOH с послед. кристаллизацией солей и высушиванием их до безводных солей или кристаллогидратов NaH2PO4.H2O, Na2HPO4.12H2O и Na3PO4.12H2O. Последний получают также нагреванием АlРО4 с Na2CO3 при 900 oС с послед. выщелачиванием водой и кристаллизацией из р-ра.
П и р о ф о с ф а т Na4P2O7 полиморфен; тригидро-NaH3P2O7, дигидро-Nа2Н2Р2О7 и гидропирофосфаты Na3HP2O7 разлагаются выше 250оС с образованием конденсированных натрия фосфатов. Получают нейтрализацией Н4Р2О7 щелочью, дегидратацией гидроортофосфатов Na, Na3HP2O7 x х 9Н2О-подкислением р-ра Na4P2O7 соляной к-той.
Табл. 1.-СВОЙСТВА ОРТО- И ПИРОФОСФАТОВ НАТРИЯ
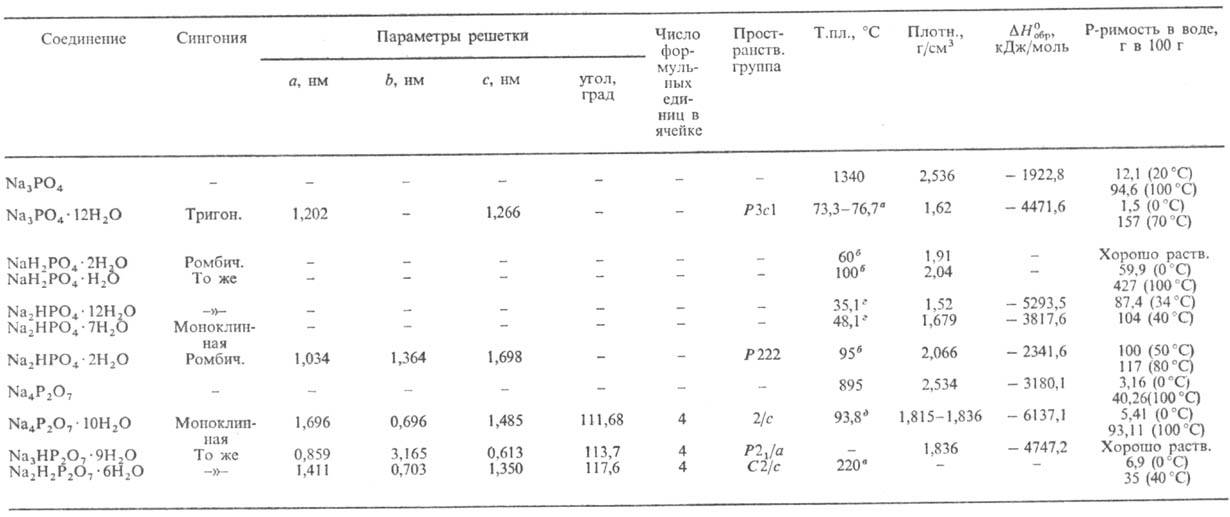
a С потерей воды, полное обезвоживание при 100 °С. б Полное обезвоживание при 95 °С. в Полное обезвоживание. г С потерей 5 молекул воды. д Теряет 1 молекулу воды, не плавясь.
Табл. 2.-ХАРАКТЕРИСТИКА КОНДЕНСИРОВАННЫХ ФОСФАТОВ НАТРИЯ
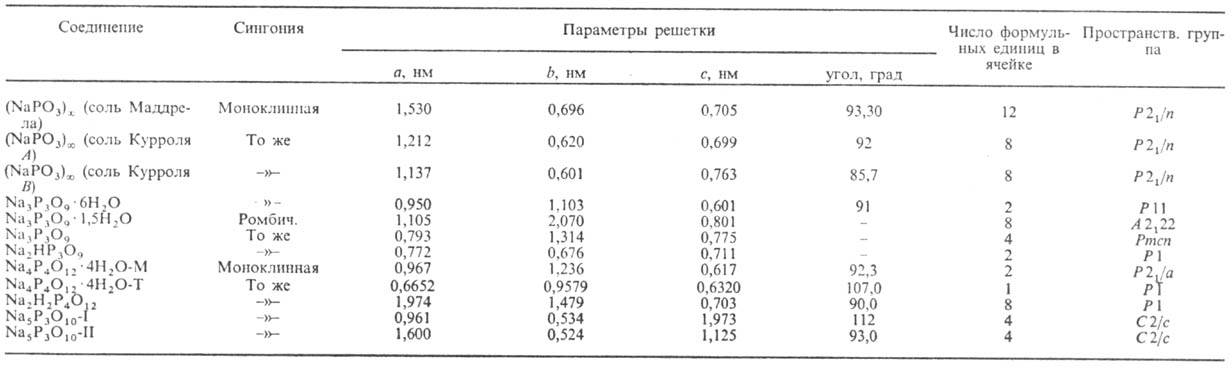
К о н д е н с и р о в а н н ы е натрия фосфаты (устар. назв.-метафосфаты натрия) содержат группировку (РО3)-. Полифосфаты  имеют линейное цепочечное строение, циклофос-фаты (NaPO3)n, где п = 3,4,12-циклическое.
имеют линейное цепочечное строение, циклофос-фаты (NaPO3)n, где п = 3,4,12-циклическое.
Структура полифосфатов Na определяется условиями их получения. Нагревание NaH2PO4 при 500°С приводит к получению нерастворимой в воде соли Маддрела. При дегидратации расплава NaH2PO4 при высоких т-рах образуется соль Грэма  -гигроскопичное водорастворимое стекло. Если расплавл. массу выдерживают при 550-560°С и вносят затравку, то получают соль Курроля-ограниченно растворимый в воде полифосфат с волокнистой структурой. В пром-сти трициклофосфат Na3P3O9 получают дегидратацией NaH2PO4 при 500 — 600°С или прокаливанием Na4P2O7 с NH4Cl, гидраты - выпариванием р-ров с эквимолярным содержанием Na2O и Р2О5.
-гигроскопичное водорастворимое стекло. Если расплавл. массу выдерживают при 550-560°С и вносят затравку, то получают соль Курроля-ограниченно растворимый в воде полифосфат с волокнистой структурой. В пром-сти трициклофосфат Na3P3O9 получают дегидратацией NaH2PO4 при 500 — 600°С или прокаливанием Na4P2O7 с NH4Cl, гидраты - выпариванием р-ров с эквимолярным содержанием Na2O и Р2О5.
Тетрациклофосфат Na4P4O12 может иметь конформацшо кресла или ванны. Безводная соль известна только в конфор-мации ванны. Тетрациклофосфат Na получают при нагр. эквимолярных кол-в NaH2PO4 и Н3РО4 при 400°С с послед. медленным охлаждением плава. Получившийся Na2H2P4O12 нейтрализуют р-ром NaOH. Др. способ заключается в нейтрализации р-ра Н4Р4О12 щелочью до рН 7 при охлаждении.
Олигомерный трифосфат Na5P3O10, имеющий линейное цепочечное строение, существует в двух модификациях, т-ра перехода II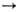 I 417°С. Образуется при плавлении смеси соли Грэма с Na4P2O7 с послед. медленным охлаждением, дегидратацией смеси Na2HPO4 и NaH2PO4 при 350-400°С (форма II) или при 500-550°С (I). Кол-во трифосфата составляет 70% от всех выпускаемых в пром-сти щелочных фосфатов.
I 417°С. Образуется при плавлении смеси соли Грэма с Na4P2O7 с послед. медленным охлаждением, дегидратацией смеси Na2HPO4 и NaH2PO4 при 350-400°С (форма II) или при 500-550°С (I). Кол-во трифосфата составляет 70% от всех выпускаемых в пром-сти щелочных фосфатов.
Натрия фосфаты применяют в качестве компонентов моющих ср-в, как умягчители воды, детергенты для очистки металлов, ПАВ в произ-ве цементов и при бурении нефтяных скважин. Особенно хорошим моющим эффектом обладают синтетич. моющие ср-ва с добавкой трифосфата Na (10-50%). Для устранения жесткости воды используют дегидратированные натрия фосфаты, образующие комплексы с Mg, Ca, Ва и др. металлами. Натрия фосфаты применяют при обогащении руд, в произ-ве фосфатных стекол, красок и др. в качестве добавок или исходного сырья, как тeкстильно-вспомогат. в-ва, в пищ. пром-сти (разрыхлители теста, для гомогенизации и улучшения консистенции сыров, колбас, сгущенного молока), в фотографии (компоненты проявителя), в электролитич. процессах и др.
Лит.: Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ., М., 1982; Comprehensive inorganic chemistry, ed. by J.C. Bailar, A. F. Trot-man-Dickenson, v. 1, Oxf., 1973. Л. H. Комиссарова, П. П. Мельников.
