Натрий
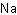
Внешний вид:
серебристо-бел. кубические металлБрутто-формула (система Хилла): Na
Формула в виде текста: Na
Молекулярная масса (в а.е.м.): 22,99
Температура плавления (в °C): 97,8
Температура кипения (в °C): 883
Растворимость (в г/100 г или характеристика):
аммиак жидкий: растворимвода: реагирует
диэтиловый эфир: не растворим
ртуть: 0,68 (18°C)
этанол: реагирует
Метод получения 1.
(лабораторный синтез)Источник информации: "Руководство по неорганическому синтезу" т.3 под ред. Брауэра Г. М.:Мир 1985 стр. 1009-1010
Синтез под вакуумом. Готовят смесь молибдата натрия с порошком циркония в соотношении 1 : 4. При нагревании смеси до ~550°С спокойно происходит выделение металлического натрия. Из молибдата натрия получают не содержащий оксидов металл с практически количественным выходом.
Метод получения 2.
(лабораторный синтез)Источник информации: "Руководство по неорганическому синтезу" т.3 под ред. Брауэра Г. М.:Мир 1985 стр. 1009-1010
Синтез под вакуумом. Готовят смесь вольфрамата натрия с порошком циркония в соотношении 1 : 4. При нагревании смеси до 450°С спокойно происходит выделение металлического натрия. Из вольфрамата натрия получают не содержащий оксидов металл с выходом 80%.
Метод получения 3.
(лабораторный синтез)Источник информации: "Руководство по неорганическому синтезу" т.3 под ред. Брауэра Г. М.:Мир 1985 стр. 1010-1012
Очень чистые щелочные металлы без примеси газов можно получить путем тщательно проведенного в высоком вакууме разложения азидов. Установка, в которой проводят разложение азидов, должна быть изготовленной из аппаратного (G20) или дюранового стекла, чтобы не происходило разъедания частей установки под действием образующихся щелочных металлов.
Для получения «физически чистого» щелочного металла все части установки спаивают; краны высоковакуумной части установки не следует смазывать. В других случаях, когда требования к чистоте получаемого металла не столь высоки, можно использовать в установке шлифовые соединения и краны; однако надо исключить контакт жидкого или газообразного щелочного металла со шлифами и с кранами.
Исходный азид прежде всего надо растереть в агатовой ступке в тонкий порошок, который затем помещают в реторту (примерно 10—12 г азида натрия). Азид, занимающий четверть объема реторты, распределяют по ней равномерно. Затем реторту припаивают к другим частям установки; для обезгаживания установку откачивают с помощью форвакуумного насоса (например, стеклянного ртутного пароструйного насоса) при одновременном нагревании. Охлаждаемые ловушки до конца работы должны быть опущены в жидкий воздух. Реторту задвигают в электрическую печь и, непрерывно поддерживая в установке вакуум, выдерживают в течение 12 ч при 200°С. Присоединенная к установке разрядная трубка должна регистрировать хороший вакуум (отсутствие свечения). Затем печь нагревают до более высокой температуры, ртутный клапан закрывают, чтобы выделяющийся при разложении азида азот не захватил азид и не загрязнил им конденсирующийся в приемнике щелочной металл.
Азид разлагается при 275 C. После начала разложения температуру регулируют таким образом, чтобы давление в установке не превышало 0,1 мм рт. ст. В случае внезапного повышения давления следует открыть кран на буферную емкость (~8-литровая колба), которая еще до начала разложения должна быть хорошо откачана (форвакуумный насос). По этой же причине следует обращать особое внимание на то, чтобы все трубки имели внутренний диаметр 12—16 мм. По достижении температуры разложения, само разложение может не начаться тотчас, а только через 3—4 ч. Поэтому нельзя допускать перегревания азида, так как это может повлечь за собой взрывоподобное разложение и вследствие этого — разрушение всей установки.
Конец разложения детектируется с помощью разрядной трубки (свободный газовый разряд отсутствует). При продолжающемся откачивании установки давление азота в ней уменьшается и щелочной металл перегоняется из реторты в приемник. Затем реторту и трубку, соединяющую приемник с форвакуумным насосом, отпаивают. Приводят в действие высоковакуумный насос (например, стеклянный ртутный диффузионный насос) и открывают ртутный клапан. Благодаря тому что высоковакуумный насос подключают к установке, предварительно откачанной форвакуумным насосом, а также используют хорошо вакуумированную буферную емкость, удается достичь остаточного давления менее 0,000 000 1 мм.рт.ст. При этом щелочной металл уже при слабом подогревании электрической печью перегоняется из приемника в приемник. Металл в приемнике расплавляют так, чтобы он стекал в ампулу, которую запаивают.
В наиболее благоприятных случаях получение щелочного металла по описанной методике продолжается 3—4 сут, в неблагоприятных (если давление в установке во время разложения азида не поднимается выше 0,1 мм.рт. ст.) — 6—8 сут. В последнем случае, однако, полученный щелочной металл совершенно не содержит газов и при нагревании такого металла в высоком вакууме не наблюдается повышения давления.
Выход натрия 100%.
Способы получения:
1. Получают электролизом расплава хлорида натрия.2. Электролизом гидроксида натрия.
3. Прокаливание карбоната натрия с углем без доступа воздуха.
Природные и антропогенные источники:
Распространенность натрия в земной коре 2,64%. Из-за высокой реакционной способности натрий находится в земной коре только в виде солей. Минералами натрия являются: анальцим, арфведсонит, боронатрокальцит, бура, галит, гаюин, гейландит, десмин, жадеит, канкринит, криолит, лазурит, мирабилит, нефелин, пирохлор, сода, чилийская селитра, глауберит, трона и др. Важнейшими минералами являются галит, мирабилит, криолит, бура и чилийская селитра.Плотность:
0,968 (20°C, г/см3)Давление паров (в мм.рт.ст.):
0,01 (289°C)0,1 (355°C)
1 (439°C)
10 (550°C)
100 (704°C)
Стандартный электродный потенциал:
Na+ + e- → Na, E = -2,714 В (вода, 25 C)Динамическая вязкость жидкостей и газов (в мПа·с):
0,814 (100°C)0,742 (132°C)
0,635 (183°C)
Поверхностное натяжение (в мН/м):
222 (100°C)211 (250°C)
Магнитная восприимчивость (в мм3/кг):
0,077000000000000000 (293 К)Удельная теплоемкость при постоянном давлении (в Дж/г·K):
1,225 (25°C)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия образования S (298 К, Дж/моль·K):
51,45 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
28,16 (т)Энтальпия плавления ΔHпл (кДж/моль):
2,64Энтальпия кипения ΔHкип (кДж/моль):
86,36Стандартная энтальпия образования ΔH (298 К, кДж/моль):
107,7 (г)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
72,3 (г)Стандартная энтропия образования S (298 К, Дж/моль·K):
153,61 (г)Аналитические
 Соли натрия окрашивают пламя в желтый цвет (на фото).
Соли натрия окрашивают пламя в желтый цвет (на фото).
Применение:
Находит применение в качестве теплоносителя в клапанах авиационных двигателей, в машинах для литья под давлением. В виде сплава с калием - как теплоноситель в ядерных реакторах. Свечение паров натрия используется в натриевых лампах. Сплав 10% натрия и 90% свинца применяется в производстве тераэтилсвинца. Соли натрия находят применение во многих отраслях жизни (лекарственные средства, пищевые компоненты, красители и т.д.).
История:
Открыт Г. Дэви в 1807 г.
Дополнительная информация:
Естественный элемент состоит всего из одного изотопа - натрий-23.
Твердость натрия по шкале Мооса = 0,5. Режется ножом. Пары натрия окрашены в пурпурно-красный цвет. Радиус иона натрия 0,095 нм. Первый потенциал ионизации 5,138 эВ, второй = 47,29 эВ.
Сплавляется со ртутью со вспышкой. Реагирует с водой и спиртами с выделением водорода. С водой образуется гидроксид, со спиртами - алкоголяты. Горит в кислороде.
- "Неорганические синтезы" сб.1 М.: ИИЛ, 1951 стр. 10
- "Энциклопедия для детей" т.17: Химия, М.:Аванта+, 2004 стр. 186
- Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. "Натрий" М.:Наука, 1986
- Иванова М.А., Кононова М.А. "Химический демонстрационный эксперимент" М.: Высшая школа, 1969 стр. 30
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 83
- Химия и Жизнь №5 1990 стр. 83
