Натрия тиосульфат
НАТРИЯ ТИОСУЛЬФАТ Na2S2O3, бесцв. кристаллы; существует в трех модификациях: a с моноклинной решеткой (а = 0,8513 нм, b = 0,8158 нм, с = 0,6425 нм, b = 97,08 °, z = 4, пространств. группа P2i/c, плотн. 2,345 г/см3), b и g; т-ры переходов a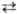 b 330 °С, b
b 330 °С, b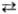 g 380 °С; DH0обр (a) —1136 кДж/моль. При нагр. в вакууме до 300 °С разлагается на Na2SO3 и S. На воздухе устойчив до 80 °С. Р-римость в воде (г в 100 г): 50,1 (0°С), 70,2 (20 °С), 231,8 (80 °С). Плотн. водных р-ров (г/см3) при 20 °С: 1,1740 (20% по массе натрия тиосульфата), 1,3827 (40%). Из водных р-ров при 11-48°С кристаллизуется пентагидрат - бесцв. кристаллы с моноклинной решеткой; т. пл. 48,5 °С (с разл.); плотн. 1,715 г/см3; С0р 360,7 Дж/моль; DH0пл 23,4 кДж/моль, DH0о6р - 2622,69 кДж/(моль.К); S0298 313,5 Дж/(моль.К). Получены ди- и гемигидраты, плавящиеся инконгруэнтно соотв. при 65,5 и 74 °С, а также метастабильные тетра- и гексагидраты. Натрия тиосульфат .-восстановитель; сильные окислители (напр., Сl2) окисляют его до Na2SO4, слабые (напр., I2 в нейтральных р-рах)-до Na2S406.
g 380 °С; DH0обр (a) —1136 кДж/моль. При нагр. в вакууме до 300 °С разлагается на Na2SO3 и S. На воздухе устойчив до 80 °С. Р-римость в воде (г в 100 г): 50,1 (0°С), 70,2 (20 °С), 231,8 (80 °С). Плотн. водных р-ров (г/см3) при 20 °С: 1,1740 (20% по массе натрия тиосульфата), 1,3827 (40%). Из водных р-ров при 11-48°С кристаллизуется пентагидрат - бесцв. кристаллы с моноклинной решеткой; т. пл. 48,5 °С (с разл.); плотн. 1,715 г/см3; С0р 360,7 Дж/моль; DH0пл 23,4 кДж/моль, DH0о6р - 2622,69 кДж/(моль.К); S0298 313,5 Дж/(моль.К). Получены ди- и гемигидраты, плавящиеся инконгруэнтно соотв. при 65,5 и 74 °С, а также метастабильные тетра- и гексагидраты. Натрия тиосульфат .-восстановитель; сильные окислители (напр., Сl2) окисляют его до Na2SO4, слабые (напр., I2 в нейтральных р-рах)-до Na2S406.
Натрия тиосульфат получают р-цией S с р-ром Na2SO3, взаимод. H2S и SO2 с р-ром NaOH, р-цией NaHS (либо Na2S2) с NaHSO3 или Na2S с SO2 и Na2CO3, как побочный продукт в произ-ве NaHSO3, сернистых красителей, при очистке пром. газов от S. Применяют натрия тиосульфат для удаления хлора при отбеливании тканей, как закрепитель в фотографии, реактив в иодомет-рии, противоядие при отравлении соед. Hg, As и др., противовоспалит. ср-во.
Лит. см. при ст. Натрия сульфит. Л. Н. Куликова.
