Натрия сульфат
Синонимы:
тенардит Внешний вид:
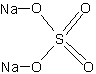
бесцветн. ромбические кристаллыБрутто-формула (система Хилла): Na2O4S
Формула в виде текста: Na2SO4
Молекулярная масса (в а.е.м.): 142,04
Температура плавления (в °C): 884
Растворимость (в г/100 г или характеристика):
вода: 4,5 (0°C)вода: 9,6 (10°C)
вода: 19,2 (20°C)
вода: 27,9 (25°C)
вода: 40,8 (30°C)
вода: 49,8 (32°C)
вода: 49,8 (38°C)
вода: 48,4 (40°C)
вода: 45,3 (60°C)
вода: 43,3 (80°C)
вода: 42,3 (100°C)
глицерин: растворим
метанол: 2,46 (20°C)
метанол: 2,32 (40°C)
метанол: 1,84 (50°C)
этанол: 0,44 (20°C)
этанол: 0,48 (40°C)
Плотность:
2,7 (20°C, г/см3)Поверхностное натяжение (в мН/м):
195 (900°C)190 (950°C)
188 (1000°C)
185 (1080°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-1384,6 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-1266,8 (т)Стандартная энтропия образования S (298 К, Дж/моль·K):
149,5 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
127,3 (т)Энтальпия плавления ΔHпл (кДж/моль):
24,3Дополнительная информация:
При электролизе водного раствора сульфата натрия у катода (отрицательного электрода) происходит выделение водорода за счет протонов воды, а у анода (положительного электрода) - выделение кислорода (из воды); в результате катодное пространство обогащается ионами Na+ и OH- (щелочная среда), а анодное - ионами SO42- и H+ (кислая среда). Сам сульфат натрия в водном растворе электролизу не подвергается.
- Некрасов Б.В. "Основы общей химии" т.1 М.:Химия, 1973 стр. 203-204
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 85
Источники информации:
Синонимы/примеры:*
Глауберова соль; сульфат натрия; сернокислый натрий
*подобраны ИИ, возможны неточности
Ещё по теме
Натрия сульфат — свойства и применение
Натрия сульфат — свойства и применение
Натрия сульфат — свойства и применение
Натрия сульфит — свойства и применение
Натрия сульфит — характеристики и применение
Натрия тиосульфат — характеристики и применение
Натрия сульфид и гидросульфид — свойства и применение
