Натрия сульфат
Натрия сульфат, сернокислый натрий, Na2SO4, соль; бесцветные кристаллы. Встречается в природе в виде минерала тенардита; плотность 2,698 г/см3, tпл 884 °С. Растворимость в воде (%): 16,3 (20 °С), 29,8 (100 °C). Безводный Na2SO4 устойчив выше температуры 32,384 °С, ниже этой температуры кристаллизуется Na2SO4×10H2O. В природе этот кристаллогидрат образует минерал мирабилит (глауберову соль). Встречаются также двойные соли натрия сульфата с др. сульфатами, например астраханит Na2SO4×MgSO4×4H2O, глауберит Na2SO4×CaSO4. Значительные количества натрия сульфата содержатся рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция
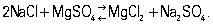
Натрия сульфат кристаллизуется в виде мирабилита. Др. способ получения натрия сульфата — взаимодействие NaCI с H2SO4 в специальных «сульфатных» печах при 500—550 °С; одновременно получается соляная кислота. Натрия сульфат применяют в стекольном производстве, при получении сульфатной целлюлозы, в текстильной, мыловаренной, кожевенной промышленности и в цветной металлургии, а также в медицине и ветеринарии (как слабительное средство).
Натрия гидросульфат NaHSO4 и натрия дисульфат (пиросульфат) N2S2O7 применяются подобно KHSO4 и K2S2O7 (см. Калия сульфат).

Дополнения к описанию натрия сульфата:
Ключевые свойства:
Практическое применение:
Интересные факты: