Свойства
. Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при высоких и довольно мало различающихся температурах. Поэтому температура плавления не может служить характерной константой для отдельных аминокислот. Большинство аминокислот легко растворимо в воде; в спиртах они, как правило, растворяются плохо.
Кислотно-основные свойства. Аминокислоты содержат одновременно основную (аминную) и кислотную (карбоксильную) группы. Для карбоксильной группы характерна способность отщеплять протон (диссоциация), в то время как аминогруппа, напротив, склонна к присоединению протона. Поэтому аминокислоты являются амфотерными соединениями, способными давать соли как с основаниями, так и с кислотами

а также могут существовать в виде внутренних солей, которые можно рассматривать как биполярные ионы:
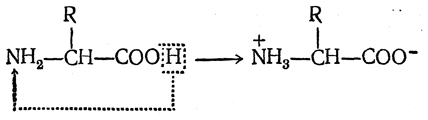
В пользу такого строения аминокислот свидетельствует ряд экспериментальных данных. Известно, что слабо диссоциированные алифатические кислоты в водных растворах обнаруживают в спектре комбинационного рассеяния характерную для карбоксильной группы линию (частота ~1650 см–1), которая при добавлении сильной щелочи исчезает, так как образующаяся соль почти полностью диссоциирована. Первичные амины в свою очередь обнаруживают в спектре комбинационного рассеяния интенсивные линии с частотой 3320—3380 см–1 В спектрах комбинационного рассеяния растворов аминокислот и те и другие линии отсутствуют. Однако при подкислении раствора аминокислоты появляется линия, отвечающая карбоксильной группе (превращение СОО– → СООН), а при подщелачивании — линия, характерная для аминогруппы (превращение +NH3 → NH2).
Водные растворы аминокислот имеют почти нейтральную реакцию (рН≈6,8). В сильнокислой среде биполярный ион аминокислоты превращается в катион
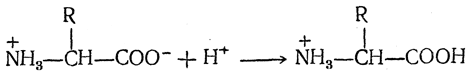
способный двигаться к катоду в электрическом поле. Константа равновесия для взаимодействия аминокислоты с протоном определяется из уравнения
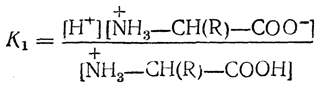
Способность карбоксильных групп отдавать протон может быть количественно охарактеризована концентрацией водородных ионов, при которой диссоциировано 50% карбоксильных групп, т. е. когда
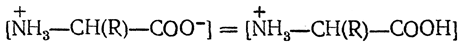
В этих условиях [Н+]=К1
Обычно пользуются не самой величиной К1, а по аналогии с рН — ее отрицательным логарифмом рК=—lgК1 Величина pK1 простейшей аминокислоты — глицина равна 2,34, т. е. при кислотности, соответствующей рН=2,34, концентрация биполярных ионов NH3—СН2—СОО– равна концентрации катионов
NH3—CH2—COOH.
Глицин — значительно более сильная кислота, чем уксусная, для которой pK1=4,3. Повышенная степень диссоциации карбоксильной группы в глицине по сравнению с уксусной кислотой объясняется влиянием положительно заряженной группы +NH3, которая способствует отрыву протона карбоксильной группы.
Если группа +NH3 отделена от карбоксильной не одним, как в глицине, а несколькими углеродными атомами, то ее влияние заметно ослабевает. Так, для β-аланина pK1=3,6, для ε-аминокапроновой кислоты pK1=4,43.
В щелочной среде биполярный ион аминокислоты превращается в анион
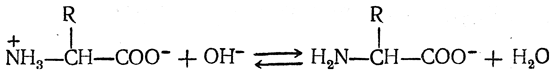
способный в электрическом поле двигаться к аноду. Константа равновесия реакции определяется уравнением
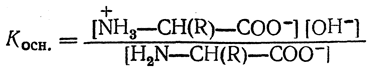
Способность аминогруппы данной аминокислоты связывать протон характеризуется концентрацией гидроксильных ионов, при которой
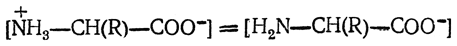
В этих условиях Косн.=[ОН–].
Для удобства основность аминокислот характеризуют величиной рК2=14—рКосн., используя соотношение [Н+][ОН–]=14.
Для глицина рК2=9,72, в то время как для этиламина рК2=10,82. Следовательно, алифатические амины прочнее связывают протон, чем аминогруппы аминокислот. Это объясняется, по-видимому, влиянием группы
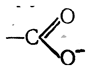
оттягивающей свободную пару электронов от атома азота аминогруппы:
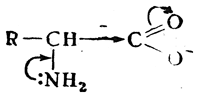
Если карбоксильная группа отделена от аминной несколькими углеродными атомами, то ее влияние ослабевает и рК2 постепенно приближается к рК алифатических аминов. Так, для β-аланина рК2=10,19, для ε-аминокапроновой кислоты рК2=10,43.
Кроме величин pK1 и рК2, для каждой аминокислоты характерна определенная величина рН, при которой число катионов в растворе разно числу анионов. При этом значении рН, называемом изоэлектрической точкой и обозначаемом pI, максимальное количество аминокислоты в растворе находится в виде биполярных ионов. В изоэлектрической точке аминокислоты не двигаются под влиянием электрического поля. Для моноаминомонокарбоновых кислот величину рН в изоэлектрической точке можно определить из уравнения
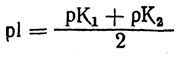
Обычно pI моноаминомонокарбоновых кислот лежит около рН = 6. Если аминокислота содержит вторую карбоксильную группу, то ее изоэлектричеокая точка смещена в область более низких значений рН. Введение в радикал аминокислоты группировки с основными свойствами (вторая аминогруппа, остаток гуаниди.на) вызывает сдвиг изоэлектрической точки в область повышенных значений рН.
Производные аминокислот, не образующие биполярных ионов, резко отличаются по свойствам от исходных аминокислот. Так, эфиры аминокислот, например NH2—CHR—СООС2Н5, близки по свойствам к алифатическим аминам, растворимы в органических растворителях и могут перегоняться в вакууме без разложения. N-Ацилированные аминокислоты полностью лишены основных свойств и напоминают алифатические кислоты.


