Стереохимия аминокислот
Большинство аминокислот содержит асимметрический атом углерода (у α-аминокислот это α-углеродный атом) и может существовать в виде оптических изомеров:

При установлений конфигурации аминокислот их принято сравнивать с L- и D-молочными кислотами, конфигурации которых установлены по L- и D-глицериновым альдегидам.
В природе встречаются только оптически активные аминокислоты, причем подавляющее большинство их относится к L-ряду. D-Формы аминокислот сравнительно редки (они входят в состав некоторых антибиотиков).
Интересно отметить физиологическое отличие аминокислот D- и L-рядов. При реакциях, происходящих в организме под действием ферментов, превращениям, как правило, подвергаются L-аминокислоты и их производные (гидролиз ацилированных аминокислот, эфиров, пептидов). Обратные примеры встречаются значительно реже (одним из примеров может служить избирательное окисление D-аминокислот в кетокислоты под влиянием фермента, содержащегося в почках млекопитающих).
Синтетически полученные аминокислоты являются рацемическими смесями антиподов. Для их разделения могут быть использованы химические методы. Очень удобна, например, дробная кристаллизация солей дибензоил-D-винной кислоты с эфирами аминокислот.
Особое значение приобрели ферментативные методы расщепления рацемических аминокислот. Чаще всего для этого используется ацилаза — фермент, выделяемый из почек свиней. Разделяемую аминокислоту (например, D,L-аланин) ацетилируют и полученный ацетил-D,L-аланин обрабатывают в водном растворе аодлазой, под действием которой происходит стереоспецифический гидролиз L-ацетилаланина:
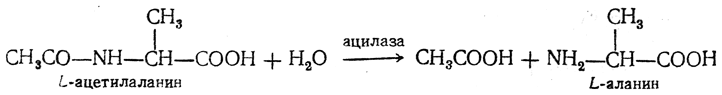
Образовавшийся свободный L-аланин легко отделяется от устойчивого к действию ацилазы ацетил-D-аланина, из которого путем кислотного гидролиза в жестких условиях можно получить свободную D-аминокислоту. Обе стереоизомерные аминокислоты удается при этом выделить с высокими выходами.


