Классификация аминокислот
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:
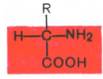
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
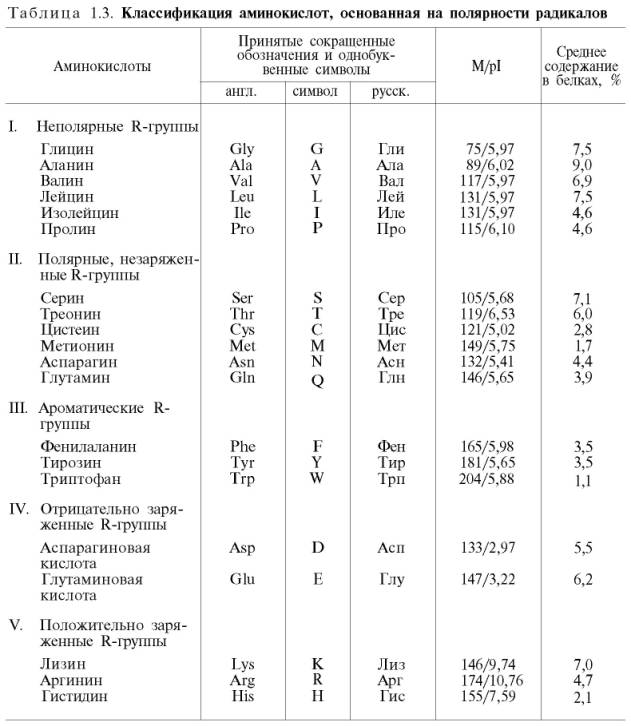
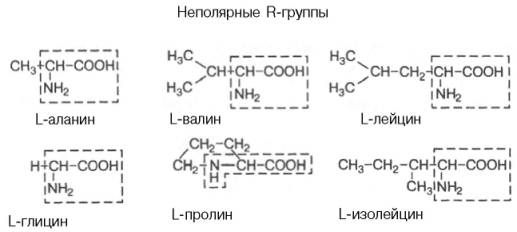
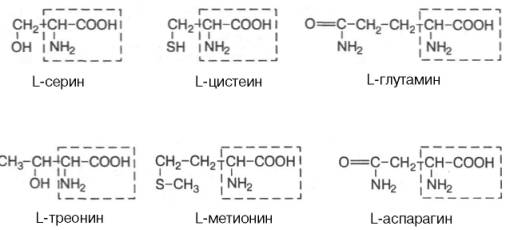
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
Полярные, незаряженные R-группы
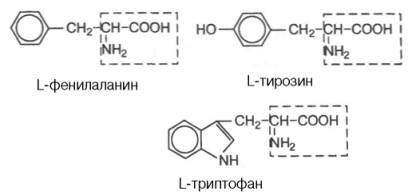
Отрицательно заряженные R-группы
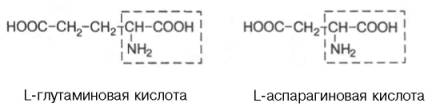
Положительно заряженные R-группы
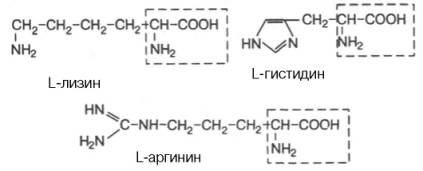
Ароматические R-группы
Перечисленные аминокислоты присутствуют в разных количественных соотношениях и последовательностях в тысячах белков, хотя отдельные индивидуальные белки не содержат полного набора всех этих аминокислот. Помимо наличия в большинстве природных белков 20 аминокислот, в некоторых белках обнаружены производные аминокислот : оксипролин, оксилизин, дийодтирозин, фосфосерин и фосфотреонин (последние две аминокислоты представлены в главе 2):
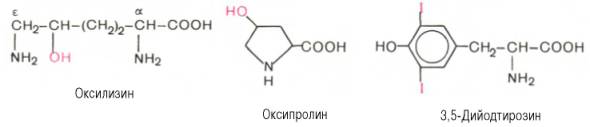
Первые две аминокислоты содержатся в белке соединительной ткани – коллагене, а дийодтирозин является основой структуры гормонов щитовидной железы. В мышечном белке миозине обнаружен также ε-N-метиллизин; в состав протромбина (белок свертывания крови) входит γ-карбоксиглутаминовая кислота, а в глутатионпероксидазе открыт селеноцистеин, в котором ОН-группа серина заменена на селен (Se):
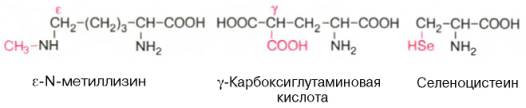
Помимо указанных, ряд α-аминокислот выполняет важные функции в обмене веществ, хотя и не входит в состав белков, в частности орнитин, цитруллин, гомосерин, гомоцистеин, цистеинсульфиновая кислота, диоксифенилаланин и др.


