Синтез белка и его созревание
А. Синтез белка в шероховатом эндоплазматическом ретикулуме
Биосинтез белка [трансляция мРНК (mRNA)] всегда начинается в цитоплазме (1). Определенная последовательность из 15-60 аминокислот в начале цепи, обозначаемая как сигнальный пептид, указывает место синтеза. Если образующийся на рибосоме белок начинается с сигнального пептида (2), ориентирующего белок на шероховатый эндоплазматический ретикулум (ШЭР), с ним связывается РНК-содержащая сигнал-узнающая частица SRP (англ signal-recognition particle) и трансляция временно прерывается (3). SRP связывает рибосому посредством SRP-рецептора с мембраной ШЭР (4). Как только рибосома закрепится на мембране, SRP-частица диссоциирует От сигнального пептида и от SRP-рецептора [при этом гидролизуется ГТФ (GTP)], и на рибосоме вновь начинается процесс трансляции (5). Белковая цепь на рибосоме растет и, еще не свернувшись, проходит через мембрану по каналу, называемому транслоконом, в просвет ШЭР (6).
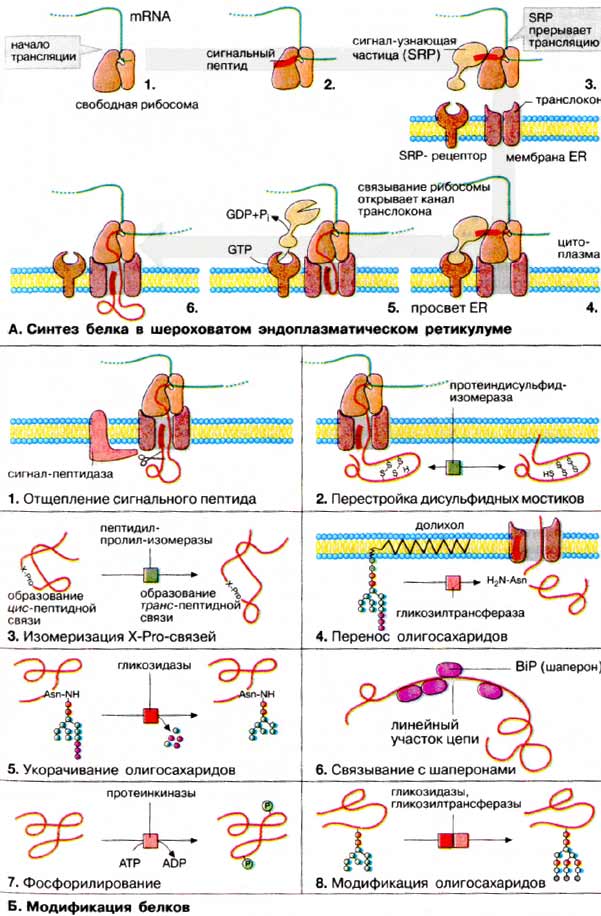
Прохождение растущего пептида через мембрану может быть прервано соответствующим стоп-сигналом. В этом случае пептид остается погруженным в мембрану и дает начало интегральному мембранному белку. В ходе белкового синтеза возможно многократное прохождение растущей цепи через мембрану и возобновление синтеза вновь при посредстве сигнального пептида Образующийся по такому механизму мембранный белок будет иметь множество трансмембранных участков.
Модификации в ШЭР. Превращение линейной немодифицированной пептидной цепи в полноценный функциональный белок (созревание) осуществляется в результате многостадийного процесса, который начинается сразу же после начала трансляции и протекает в просвете ЭР.
Прежде всего соответствующая пептидаза отщепляет сигнальный пептид (1). Фермент узнает точку расщепления в составе< специфической N-концевой последовательности белка.
Путем окисления боковых цепей цистеина образуются дисульфидные мостики, правильность положения которых контролируется протеиндисульфид-изомеразой (2).
Пептидилпролил-изомераза контролирует цис-транс-изомеризацию Х-Рго-связей в синтезируемом пептиде (3)
Трансгликозидазы переносят олигосахариды в блоке с долихолом (длинноцепочечным изопреноидом) на определенные остатки аспарагиновой кислоты в белке, тем самым осуществляя N-гликозилирование белка (4).
Гликозидазы «подстригают» олигосахариды, отщепляя избыточные остатки глюкозы и маннозы (5).
Для того чтобы растущая полипептидная цепь могла свернуться необходимым образом, с еще линейным участком цепи временно связываются шапероны (6). Эти белки направляют процесс свертывания цепи путем подавления нежелательных побочных взаимодействий. Наиболее важным шапероном, присутствующим в просвете ШЭР. является белок связывания (BiP, от англ. binding protein). Когда вновь образованный белок приобретает правильную вторичную и третичную структуру и остатки глюкозы удалены полностью, он с помощью транспортных везикул перемещается в аппарат Гольджи (см. с. 230).
Модификации в аппарате Гольджи. В аппарате Гольджи осуществляются следующие ферментативные стадии модификации белка: фосфорилирование (7) и отщепление с последующим переносом (перегруппировка) остатков сахаров с помощью гликозидаз и гликозилтрансфераз (8). Эта модификация имеет целью образование специфической олигосахаридной структуры в гликопротеинах.
Наконец, в секреторных пузырьках (везикулах) отщепляется еще один пептид (9), прежде чем содержимое секретируется посредством экзоцитоза. Это отщепление, катализируемое специфичными пептидазами, выполняет функцию активации секретируемого белка. Например, отщепление С-пептида от неактивного проинсулина приводит к образованию активного гормона инсулина.


