Процессы трансляции
Многоступенчатый матричный синтез белка, или собственно трансляцию, протекающую в рибосоме, также условно делят на 3 стадии: инициацию, элонгацию и терминацию.
Инициация трансляции. Стадия инициации, являющаяся «точкой отсчета» начала синтеза белка, требует соблюдения ряда условий, в частности наличия в системе, помимо 70S (или 80S) рибосом, инициаторной амино-ацил-тРНК (аа-тРНК), инициирующих кодонов в составе мРНК и белковых факторов инициации. Экспериментально доказано, что синтез белка инициирует единственная аминокислота – метионин. В кодовом «словаре» имеется только один кодон для метионина (АУГ), однако во всех живых организмах открыты две тРНК для метионина: одна используется при инициации синтеза белка, другая – для включения метионина во внутреннюю структуру синтезируемого полипептида в стадии элонгации (см. далее). Соответственно эти тРНК принято обозначать тРНКфМет и тРНКМет. Укажем также, что эукариотическая клетка не нуждается в формилировании метионина.
У прокариот синтез N-формилметионил-тРНК протекает в две стадии:
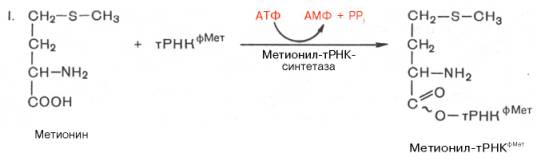
Данную стадию катализирует метионил-тРНК-синтетаза. Реакция нуждается в доставке энергии гидролиза АТФ.
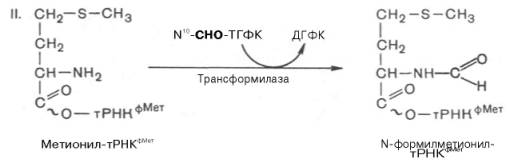
Катализирующая II стадию трансформилаза оказалась более специфичной, чем метионил-тРНК-синтетаза: она не формилирует ни свободный метионин, ни метионин в комплексе с тРНКМет.
Таким образом, N-формилметионил-тРНК является первой аа-тРНК, которая определяет включение N-концевого остатка аминокислоты и тем самым начало трансляции. Процесс формилирования имеет важный химический и биологический смысл: блокируя участие NН2-группы метионина в образовании пептидной связи, он обеспечивает тем самым синтез белка в направлении NH2 –> СООН; образовавшаяся формилметионил-тРНК, кроме того, первой связывается с определенным участком 30S субчастицы рибосомы и с мРНК.
Необходимым условием инициации, как было отмечено, является также наличие инициирующих кодонов, кодирующих формилметионин. У бактерий эту функцию выполняют триплеты АУГ и ГУГ мРНК. Однако они кодируют формилметионин (или начальный метионин в эукариотической клетке) только будучи начальными триплетами при считывании мРНК. Если эти триплеты являются обычными, т.е. внутренними, то каждый из них кодирует свою аминокислоту: в частности, АУГ кодирует метионин, а ГУГ – валин. Ясно, что начальный, инициаторный 5'-АУГ-кодон должен чем-то отличаться от других АУГ-кодонов, возможно, структурой окружения триплета. Предполагают, что инициаторному 5'-АУГ-кодону у прокариот предшествует сигнальная полипуриновая (порядка от 8 до 13 оснований) последовательность (Shine–Dalgarno sequence), которая узнается полипиримидиновой 3'-антипараллельной последовательностью в молекуле 16S рРНК 30S субчастицы. Допускается, кроме того, существование определенных различий во вторичной структуре мРНК в участке инициирующего кодона, способствующих его узнаванию.
К настоящему времени выяснена природа белковых факторов инициации. У Е. coli (см. табл. 14.1) открыты три таких инициирующих фактора, обозначаемых соответственно IF-1, IF-2, IF-3. Все они получены в высокоочищенном состоянии с примерными молекулярными массами 9000, 10000 и 22000 соответственно. IF-3 обеспечивает узнавание участка на молекуле мРНК, к которому присоединяется формилметионил-тРНК. Данный белковый фактор первым связывается со свободной 30S субчастицей рибосомы и препятствует ассоциации 30S и 50S субчастиц в 70S рибосому без молекулы мРНК. IF-1 способствует связыванию инициатор-ной формилметионил-тРНК с комплексом 30S субчастицы и мРНК. Белковый фактор IF-2, вероятнее всего, способствует объединению 30S и 50S субчастиц после того, как на первой субчастице уже присутствуют инициирующие кодоны мРНК, N-формилметионил-тРНК, IF-3, IF-1 и ГТФ. Этот белок рассматривают как фактор стабилизации всего инициаторного 70S комплекса (см. далее).
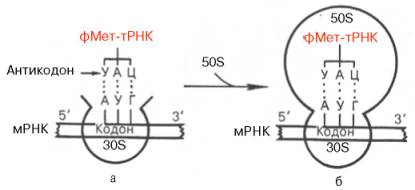
Рис. 14.5. Схематическое изображение взаимодействия формилметионил-тРНК и мРНК с 30S субчастицей рибосомы (а) и транслирующей (функционально активной) 70S рибосомой (б).
Аналогичные белковые факторы инициации обнаружены также в эука-риотических клетках. Открыто около 10 эукариотических белковых факторов инициации (см. табл. 14.1), их принято обозначать eIF. Все они, по-видимому, важны для инициации, однако только три из них абсолютно необходимы и существенны для белкового синтеза: eIF-2, eIF-3 и eIF-5. Они получены в чистом виде: eIF-2 состоит из α-, β- и γ-субъединиц (мол. масса 38000, 47000 и 50000 соответственно), eIF-3 (мол. масса 500000–700000) и eIF-5 (мол. масса 125000). Укажем также, что в синтезе белка их роль тождественна роли инициаторных белков у прокариот. Отличительной особенностью синтеза белка у эукариот является, кроме того, наличие среди 10 белковых факторов инициации еще одного белка, названного кэп-связы-вающим. Соединяясь с 5'-участком кэп мРНК, этот белок содействует образованию комплекса между мРНК и 40S рибосомной субчастицей. Необходимо отметить, что до сих пор не раскрыты тонкие молекулярные механизмы участия белковых факторов инициации как у про-, так и у эукариот в сложном процессе синтеза белка.
Образование инициаторного комплекса. Экспериментально доказано, что в процессе белкового синтеза наблюдаются постоянная диссоциация 70S рибосом на 30S и 50S субчастицы и последующая их реассоциация. Сначала образуется инициаторный комплекс путем присоединения белковых факторов, формилметионил-тРНК и ГТФ к 30S субчастице, к которой комплементарно антикодону формилметионил-тРНК присоединяется мРНК при участии кодона АУГ (рис. 14.5).
Следует указать на особую роль формилметионил-тРНК: она помогает мРНК найти на 30S субчастице определенное местоположение, обеспечивающее точную трансляцию информации о последовательности аминокислот в полипептидной цепи (установление рамки). Как только мРНК присоединяется к комплексу, высвобождается белковый фактор IF-3 и оставшийся комплекс легко присоединяет 50S субчастицу, образуя транслирующую, т.е. функционально активную, 70S рибосому. В процессе этих перестроек рибосомы освобождают остальные белковые факторы инициации и продукты гидролиза ГТФ (ГДФ и неорганический фосфат), энергия которого расходуется, по-видимому, на формирование инициирующего 70S комплекса рибосомы. В этом комплексе формилметионил-тРНК оказывается прикрепленной к пептидилсвязывающему центру рибосомы. В гидролизе ГТФ принимает участие IF-2. У образовавшейся активной, полностью сформировавшейся 70S рибосомы, содержащей формилметио-нил-тРНК, оказывается свободным аминоацильный центр, который может реагировать с определенной аа-тРНК, соответствующей очередному кодону мРНК. С этого момента начинается II этап синтеза белка – элонгация.
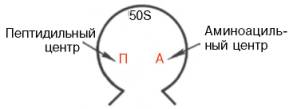
Рис. 14.6. 50S субчастица рибосомы с двумя центрами связывания тРНК.
Элонгация трансляции. Процесс элонгации полипептидной цепи у Е. coli начинается с образования первой пептидной связи и непосредственно, точнее топографически, связан с большой субчастицей (50S) рибосомы, содержащей два центра для связывания тРНК: один из них называется аминоацильным (А), другой – пептидильным (П) (рис. 14.6).
В процессе элонгации у Е. coli также участвует три белковых фактора – элонгационные факторы трансляции, сокращенно обозначаемые Tu, Ts и G (см. табл. 14.1): EF-Tu (мол. масса 43000), EF-Ts (мол. масса 35000) и EF-G (мол. масса 80000). У эукариот также открыты три таких фактора, названных эукариотическими элонгационными факторами трансляции и обозначаемых соответственно eEF-1α (мол. масса 53000), eEF-1αβ (мол. масса 30000) и eEF-2; почти все они получены в чистом виде, для ряда из них установлена первичная структура.
Процесс элонгации принято делить на 3 стадии: узнавание кодона и связывание аминоацил-тРНК, образование пептидной связи и транслокация. На I стадии в соответствии с природой кодона мРНК в свободный А-участок рибосомы доставляется аминоацил-тРНК при участии фактора элонгации Tu. Этот процесс требует затраты энергии и сопряжен с гидролизом ГТФ и образованием прочно связанного комплекса Тu–ГТФ. Образовавшийся комплекс подвергается диссоциации только в присутствии второго фактора элонгации Ts, при котором освободившийся фактор Tu может вновь, соединяясь с молекулой ГТФ, принять участие в доставке аа-тРНК в рибосому. Таким образом, в транслирующей 70S рибосоме в пептидильном центре располагается формилметионил-тРНК, а в А-центре – аминоацил-тРНК (первая аминокислота после метионина). С этого момента начинается II стадия элонгации – образование первой пептидной связи. Для этого в рибосоме осуществляется ферментативная реакция транспептидирования между формилметионил-тРНК в П-центре и новой аа-тРНК в А-центре. В процессе этой реакции остаток формилметионина переносится на свободную NH2-группу аа-тРНК и замыкается первая пептидная связь в будущей полипептидной цепи. Параллельно из пеп-тидильного центра освобождается тРНКфМет в цитозоль. Фермент, катализирующий реакцию транспептирования, получил название пептидил-трансферазы (рис. 14.7); он, вероятнее всего, является составной частью белков 50S субчастицы. Таким образом, в процессе транспептидазной реакции в А-центре образуется дипептидил-тРНК, а П-центр остается свободным («вакантным»).
На III стадии процесса элонгации необходимо иметь свободный амино-ацильный центр для присоединения следующей аа-тРНК. Для этого благодаря процессу транслокации образовавшийся фрагмент дипептидил-тРНК переносится от аминоацильного на пептидильный центр. Достигается транслокация благодаря передвижению рибосомы относительно мРНК при участии фермента транслоказы (функцию ее выполняет фактор элонгации G у Е. coli и eEF-2 у эукариот) за счет использования энергии распада еще одной молекулы ГТФ. В результате транслокации дипептидил-тРНК занимает место в пептидильном центре рибосомы, а аминоацильный центр освобождается для нового цикла узнавания и может присоединить новую следующую аа-тРНК, соответствующую кодону мРНК. В процессе транслокации рибосома перемещается вдоль мРНК по направлению к ее 3'-концу на расстояние в один кодон, т.е. точно на один триплет. На рис. 14.8 видно, что рибосома вступает в следующий цикл – происходит присоединение третьего аминокислотного остатка и т.д.
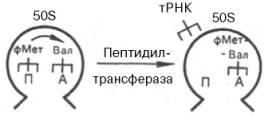
Рис. 14.7. Перенос фМет-тРНК между двумя центрами (П и А) на большой 50S субчастице рибосомы.
Таким образом, на стадии элонгации происходит последовательное наращивание полипептидной цепи по одной аминокислоте в строгом соответствии с последовательностью триплетов (кодонов) в молекуле мРНК.
Существенным является выяснение вопроса о количестве энергии, необходимой для синтеза одной пептидной связи при биосинтезе белка. Как было отмечено, при активировании аминокислоты еще до стадии инициации, т.е. при формировании аа-тРНК, расходуется энергия распада АТФ на АМФ и пирофосфат, что приблизительно эквивалентно гидролизу 2 молекул АТФ до 2 молекул АДФ, поскольку пирофосфат подвергается распаду на 2 молекулы неорганического фосфата. Для включения амино-ацил-тРНК в аминоацильный центр используется энергия гидролиза молекулы ГТФ на ГДФ и неорганический фосфат. Наконец, транслокация транслирующей 70S рибосомы также нуждается в энергии гидролиза еще одной молекулы ГТФ. Таким образом, энергетические потребности синтеза каждой пептидной связи эквивалентны энергии гидролиза 2 молекул АТФ и 2 молекул ГТФ (т.е. гидролиз четырех макроэргических фосфатных связей) до соответствующих нуклеозиддифосфатов. Легко представить, насколько велики энерготраты каждой клетки при синтезе не только одной молекулы белка, а множества молекул самых разнообразных белков в единицу времени.
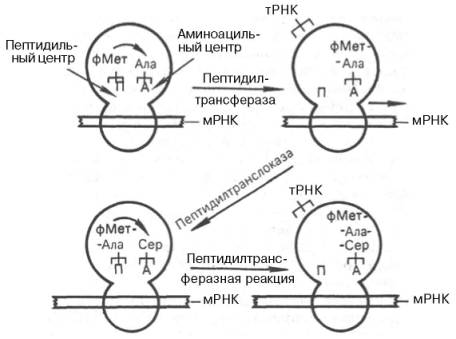
Рис. 14.8. Процесс элонгации полипептидной цепи (схема).
Терминация трансляции. На IV стадии биосинтеза белка завершается синтез полипептидной цепи в 70S рибосоме при участии трех белковых факторов терминации (рилизинг-факторов). Эти белки обозначаются RF-1 (мол. масса 47000), RF-2 (мол. масса 35000–48000) и RF-3 (мол. масса 46000) у прокариот (см. табл. 14.1). В клетках животных открыт один-единственный белок с аналогичным свойством – рилизинг-фактор R (eRF, мол. масса 56000–105000). У Е. coli RF-1 наделен свойством узнавания в молекуле мРНК терминирующих кодонов УАГ и УАА , a RF-2 – соответственно УГА и УАА. Эукариотический рилизинг-фактор eRF узнает все три терминирующих кодона (нонсенс-кодоны) и индуцирует освобождение синтезированного полипептида опосредованно через пептидил-трансферазу. После того как терминирующий кодон мРНК занимает свое место в аминоацильном центре рибосомы, к нему присоединяется не тРНК, поскольку отсутствуют соответствующие антикодоны тРНК, узнающие этот терминальный сигнал, а один из белковых факторов терминации и блокируется далнейшая элонгация цепи. Считают, что терминирующие кодоны и белковые факторы индуцируют изменение специфичности пеп-тидилтрансферазной активности таким образом, что она катализирует перенос растущей пептидной цепи, скорее, к молекуле воды, вызывая гидролиз, чем к аминогруппе аминокислоты. Следствием этого являются отделение белковой молекулы от рибосомы и освобождение молекул тРНК и мРНК (последняя подвергается распаду до свободных рибонуклеотидов). Одновременно 70S рибосома диссоциирует на две субчастицы – 30S и 50S, которые поступают в свободный пул и могут вновь использоваться для реассоциации новой рибосомы. Схематически этот процесс представлен на рис. 14.9. ГТФ в терминации трансляции у Е. coli рассматривается в качестве аллостерического регулятора, а у эукариотов ГТФ, вероятнее всего, распадается на ГДФ и Pi.
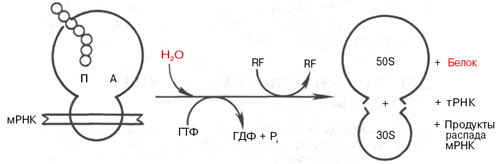
Рис. 14.9. Процесс терминации синтеза белка (схема).
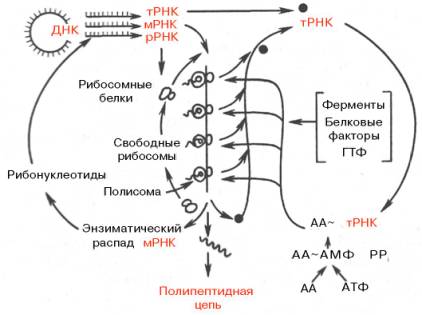
Рис. 14.10. Схематическое изображение роли разных типов РНК в синтезе белка (по Уотсону).
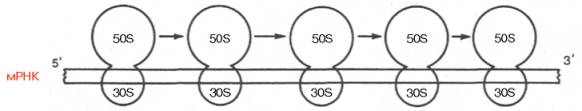
Рис. 14.11. Схематическое изображение организации бактериальной полирибосомы (полисомы) и движения рибосом вдоль мРНК.
В общей форме зависимость между репликацией ДНК, транскрипцией и трансляцией мРНК представлена на рис. 14.10. Видно, что одна матричная мРНК транслируется не одной рибосомой, а одновременно многими рибосомами, расположенными близко друг к другу. Подобные скопления рибосом на мРНК получили название полирибосом, или полисом (рис. 14.11). Они значительно повышают эффективность использования мРНК, т.е. ускоряют синтез белка.
Рибосомы движутся в направлении 5' –> 3' вдоль цепи мРНК, причем каждая рибосома работает самостоятельно, синтезируя отдельный белок. Полисома, таким образом, позволяет обеспечить высокую скорость трансляции единственной мРНК (см. рис. 14.11).


