Транслокация белков. Шапероны
А. Транслокация белков
Перенос белков через биомембраны осуществляется специальными транспортными системами.
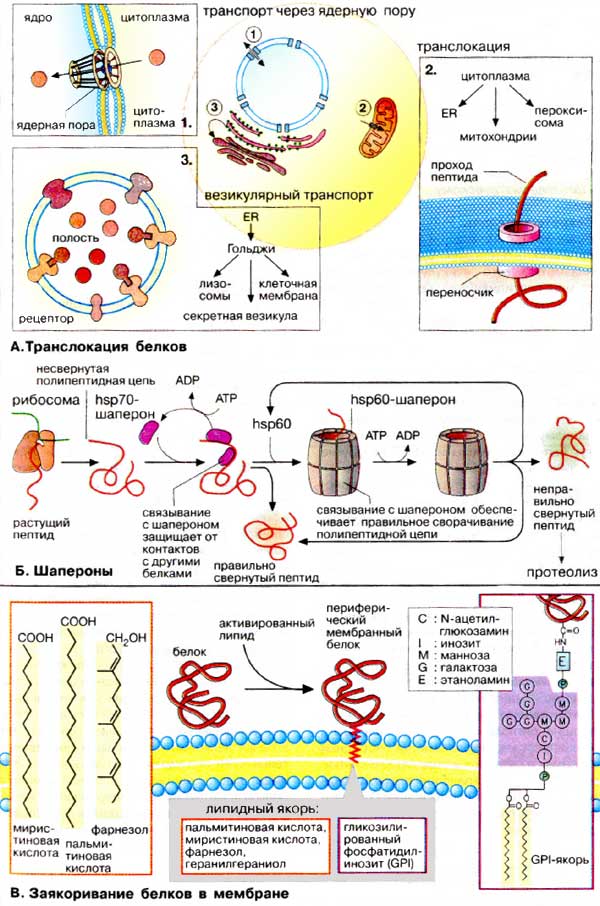
1. Пориновый комплекс. Из цитоплазмы в ядро белки попадают через крупный (125000 кДа) заполненный водой пориновый комплекс. Транспорт белков через комплекс энергозависим и поэтому может регулироваться Ядерные белки несут одну или несколько сигнальных последовательностей, с помощью которых они связываются с пориновым комплексом и импортируются с сохранением третичной структуры.
2. Переносчики белков. Импорт белков из цитоплазмы в органеллы осуществляется белками-переносчиками, которые представляют собой белковые комплексы, переносящие линейные полипептиды через биомембраны энергозависимым образом. Специфичность процесса обеспечивается за счет связывания сигнальной последовательности с ближайшим рецептором (на схеме не приведен) Процессы развертывания и вторичной укладки белков контролируются шаперонами.
3. Везикулярный транспорт. Перенос белков от одних органелл к другим происходит с помощью везикул. Везикулы отпочковываются от мембран одной органеллы, а затем исчезают, сливаясь с мембраной другой органеллы. Белки переносятся в полости пузырька или в составе мембран подобно интегральным белкам.
Б. Шапероны
Пептидная цепь, растущая в процессе трансляции, принимает вторичную и третичную структуру в результате сложного многоступенчатого процесса, идущего во времени Для образования правильной структуры с еще несвернувшейся пептидной цепочкой связываются специальные белки — шапероны. Шапероны обладают сродством к экспонированным гидрофобным участкам полипептидной цепи. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия для нормального сворачивания растущего пептида. Взаимодействие с шаперонами — процесс энергозависимый: при освобождении шаперонов гидролизуется АТФ (АТР).
Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока (hsp60, hsp70, hsp90). Свое название эти белки получили потому, что и к синтез возрастает при повышении температуры и других формах стресса. При этом они выполняют функцию защиты белков клетки от денатурации. Белки — представители семейства hsp70 — связываются на начальной фазе образования растущего пептида. Одни из них контролируют процесс сворачивания белка в цитоплазме, другие — участвуют в переносе белков в митохондрии. Белки hsp60 охватывают синтезированный полипептид наподобие бочонка, тем самым обеспечивая условия для принятия правильной конформации.
В. Заякоривание белков в мембранах
Белки, синтезируемые в ШЭР и несущие «стоп-транспорт-сигнал», остаются в мембране ШЭР и закрепляются там за счет гидрофобных взаимодействий в качестве интегральных мембранных белков. Фиксация белка в мембране может быть также осуществлена путем присоединения липофильного якоря. Такие периферические мембранные белки присоединяют липиды во время или сразу после трансляции. Соответствующий сигнал обычно содержится в белке в форме специфической пептидной последовательности.
Мембранными якорями являются жирные кислоты (ацильные остатки, см. с. 54) или изопреноиды (пренильный остаток, см. с. 58). Белки могут быть ацилированы пальмитиновой (C16) или миристиновой (C14) кислотами, пренилированы путем связывания с фарнезолом (С15) или геранилгераниолом (С20).
Некоторые белки несут на С-конце гликозилированный фосфатидилинозит (ГФИ (GPI)]. В эту группу входят многие адгезионные молекулы (например, N-CAM, гепаринсульфатпротеогликан), ряд мембранных ферментов, таких, как щелочная фосфатаза, ацетилхолинэстераза и различные протеиназы.


