Переваривание белков
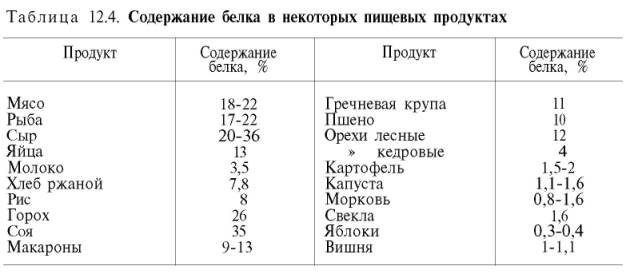
Главными источниками белков для человека являются пищевые продукты животного и растительного происхождения. В табл. 12.4 представлены средние данные о содержании белка в основных пищевых продуктах. Главным образом животные (мясо, рыба, сыр) и только некоторые растительные (горох, соя) продукты богаты белками, в то время как наиболее распространенные растительные пищевые продукты содержат небольшие количества его.
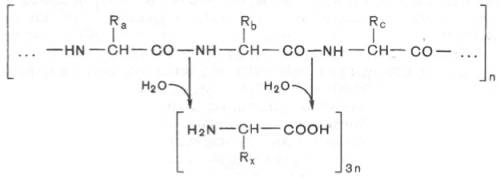
Весь сложный процесс переваривания пищевых белков в пищеварительном тракте «настроен» таким образом, чтобы путем последовательного действия протеолитических ферментов лишить белки пищи видовой и тканевой специфичности и придать продуктам распада способность всасываться в кровь через стенку кишечника. Примерно 95–97% белков пищи всасывается в виде свободных аминокислот. Следовательно, ферментный аппарат пищеварительного тракта осуществляет поэтапное, строго избирательное расщепление пептидных связей белковой молекулы вплоть до конечных продуктов гидролиза белков – свободных аминокислот. Гидролиз заключается в разрыве пептидных связей —СО—NH— белковой молекулы.
Протеолитические ферменты (протеиназы) обладают широкой специфичностью действия, определяемой как размером полипептида, так и структурой радикалов аминокислот, участвующих в образовании пептидной связи. Основные ферменты, катализирующие гидролитический распад пищевых белков и пептидов, приведены в табл. 12.5.
Следует подчеркнуть, что с пищей человек получает огромное разнообразие белков, однако все они подвергаются воздействию ограниченного числа протеиназ. Эти ферменты относятся к классу гидролаз (см. главу 4) и часто называются также пептидазами. Известны две группы пептидаз: экзопептидазы, катализирующие разрыв концевой пептидной связи с освобождением одной какой-либо концевой аминокислоты, и эндопеп-тидазы, преимущественно гидролизующие пептидные связи внутри полипептидной цепи. Эндопептидазы обладают разной субстратной специфичностью действия, всецело определяемой природой радикалов аминокислот по соседству с разрываемой пептидной связью, поэтому белковая молекула распадается под действием разных эндопептидаз на строго определенное число пептидов, сравнительно легко идентифицируемых методами хроматографии и электрофореза (метод отпечатков пальцев). Это свойство эндопептидаз нашло широкое применение в исследовательской работе при выяснении первичной структуры индивидуальных белков.



