Протеолиз
Для полного расщепления белков до свободных аминокислот необходимо несколько ферментов с различной специфичностью. Протеиназы и пептидазы имеются не только в желудочно-кишечном тракте, но и в клетках. По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы. Эндопептидазы, или протеиназы, расщепляют пептидную связь внутри пептидной цепи. Они «узнают» и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определенными аминокислотными остатками. Протеиназы классифицируются по механизму реакции. Сериновые протеиназы (схема В) содержат в активном центре важный для каталитического действия этих ферментов остаток серина, в цистеиновых протеиназах таким является остаток цистеина и т.д. Экзопептидазы гидролизуют пептиды с конца цепи: аминопептидазы — с N-конца, карбоксипептидазы — с С-конца. Наконец, дипептидазы расщепляют только дипептиды.
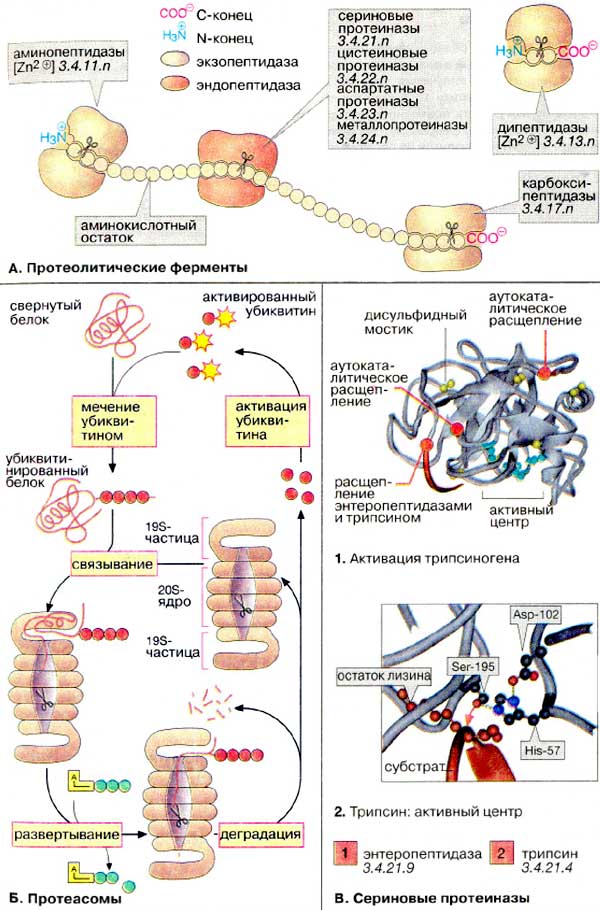
Б. Протеасомы
Поскольку функциональные белки клетки должны быть защищены от преждевременного протеолиза, часть протеолитических ферментов клетки заключена в липосомы. Другая хорошо регулируемая система деградации белков локализована в цитоплазме. Она состоит из больших белковых комплексов (молекулярная масса 2ּ106 Да), протеасом. Протеасомы содержат бочковидное ядро из 28 субъединиц и имеют коэффициент седиментации 20S. Протеолитическая активность (на схеме показана в виде ножниц) локализована во внутреннем 20S-ядре. С торцов бочки запираются сложно устроенными 19S-частицами, контролирующими доступ в ядро.
Белки, которым предстоит разрушение в протеасоме (например, содержащие ошибки транскрипции или состарившиеся молекулы), метятся путем ковалентного связывания с небольшим белком убиквитином. Убиквитин активирован благодаря наличию тиолсложноэфирной связи. Меченые убиквитином («убиквитинированные») молекулы распознаются 19S-частицами с потреблением АТФ и попадают в ядро, где происходит их деградация. Убиквитин не разрушается и после активации используется вновь.
В. Сериновые протеиназы
Большая группа протеиназ содержит в активном центре серин. К сериновым протеиназам принадлежат, например, ферменты пищеварения трипсин, химотрипсин и эластаза, многие факторы свертывания крови, а также фибринолитический фермент плазмин и его активаторы.
Как показано на рис. 265, панкреатические протеиназы секретируются в виде проферментов (зимогенов). Активация таких ферментов основана на протеолитическом расщеплении. Процесс активации показан на примере трипсиногена, предшественника трипсина (1). Она начинается с отщепления N-концевого гексапептида энтеропептидазой («энтерокиназой»), специфической сериновой протеиназой, которая локализована в мембранах кишечного эпителия. Продукт расщепления (β-трипсин) ферментативно активен и расщепляет следующую молекулу трипсиногена в местах, отмеченных на рисунке красным цветом (аутокаталитическая активация). Проферменты химотрипсина, эластазы, карбоксипептидазы А и др. также активируются трипсином.
Активный центр трипсина показан на схеме 2. Остаток серина при участии остатков гистидина и аспартата нуклеофильно атакует расщепляемую связь (красная стрелка). Отщепляемая часть пептидного субстрата расположена в С-концевой стороне от остатка лизина, боковая цепь которого во время катализа фиксируется в специальном «кармане» фермента (на схеме слева).


