Механизм реакции
МЕХАНИЗМ РЕАКЦИИ. Понятие используется в осн. в двух смыслах. Для сложных реакций, состоящих из неск. стадий, механизм реакции-это совокупность стадий, в результате к-рых исходные в-ва превращаются в продукты. Для простой р-ции (элементарной р-ции, элементарной стадии), к-рая не может быть разложена на более простые хим. акты, выяснение механизма реакции означает идентифицирование физ. процессов, составляющих сущность хим. превращения. Для одной частицы (молекула в основном или возбужденном состоянии, ион, радикал, диффузионная пара, синглетная или триплет-ная радикальная пара, комплекс) или двух (редко трех) частиц (молекул, ионов, радикалов, ион-радикалов и т.п.), находящихся в определенных квантовых состояниях, изменения в положениях атомных ядер и состояниях электронов составляют суть их превращений в другие частицы с присущими этим частицам квантовыми состояниями. В рассматриваемые физ. процессы часто включают в явном виде акты передачи энергии от частицы к частице. Для элементарных реакций в растворе механизм реакции включает изменения в ближней сольватной оболочке превращающихся частиц.
Гипотетич. представления относительно механизма реакции формируются на основе имеющихся эксперим. фактов и результатов теоретич. анализа. Новые данные могут привести к изменению или уточнению предложенного механизма реакции, все более приближая его к истинному.
Сложные реакции. Стехиометрич. ур-ние, как правило, не отражает истинного механизма реакции. Так, газофазная термически активируемая неразветвленная цепная р-ция Н2 + Вr2 2НВr состоит из след. простых стадий: термич. инициирование Вr2
2НВr состоит из след. простых стадий: термич. инициирование Вr2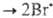 ; продолжения цепи
; продолжения цепи 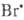 + Н2
+ Н2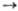 НВr +
НВr + 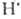 ;
; 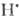 + + Вr2
+ + Вr2 НВr +
НВr + 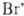 ;
; 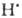 + НВr
+ НВr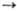 Н2 +
Н2 +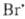 ; обрыв цепи
; обрыв цепи 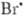 + +
+ + 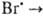 Вr2. Скорость процесса описывается сложным ур-нием, включающим константы скорости всех простых стадий и концентрации в-в Вr2, Н2 и НВr. Другой пример -нуклеоф. замещение при атоме С, соответствующее стехиометрич. ур-нию RX + Y-
Вr2. Скорость процесса описывается сложным ур-нием, включающим константы скорости всех простых стадий и концентрации в-в Вr2, Н2 и НВr. Другой пример -нуклеоф. замещение при атоме С, соответствующее стехиометрич. ур-нию RX + Y-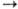 RY+X-, к-рое в зависимости от природы реагентов и р-рителя может идти по двум разл. механизмам SN2 и SN1 (см. Нуклеофильные реакции).
RY+X-, к-рое в зависимости от природы реагентов и р-рителя может идти по двум разл. механизмам SN2 и SN1 (см. Нуклеофильные реакции).
Характеризуя механизм сложной р-ции, часто указывают на его главную отличит. особенность: ионный механизм реакции, когда наиб. характерно участие в отдельных стадиях ионов; радикальный механизм реакции, радикально-цепной, нуклеоф. или элект-роф. замещение и т.п. Иногда механизм реакции называют по имени исследователя, его предложившего и доказавшего, напр. механизм реакции Налбандяна - Воеводского для взаимод. Н2 с О2, механизм реакции Бендера для замещения при карбонильном атоме С и т. п.
Установление механизма сложной р-ции начинается с изучения изменения во времени концентраций исходных в-в и, если возможно, промежут. в-в, определения порядков р-ции по отдельным реагентам при широком диапазоне вариации условий (т-ра, начальные парциальные и суммарные давления для газофазных р-ций; исходные и суммарные концентрации реагентов, природа р-рителя для р-ций в р-рах). На основе полученных данных предлагают одну или неск. возможных схем р-ции и составляют системы дифференц. ур-ний. При решении этих систем с помощью ЭВМ различают прямую и обратную задачи. В прямой задаче константы скорости и константы равновесия отд. простых стадий, полученные экспериментально или оцененные независимым путем, задают ЭВМ, к-рая численно или графически представляет результаты решения системы ур-ний в виде кинетич. кривых сложной р-ции. Затем эти кривые сопоставляют с эксперим. данными. В обратной задаче, существенно более сложной, ЭВМ на основе схемы р-ции и всего объема кинетич. сведений "выдает" константы скорости отдельных стадий. Чем сложнее кинетич. закономерности (смена порядка р-ций, запределивание кинетич. кривых, появление на них изломов и др. особенностей), тем больше возможностей, сопоставляя эксперим. данные и результаты расчетов, дискриминировать ту или иную схему в поисках истинного механизма реакции.
Важную роль в установлении механизма реакции играет исследование природы продуктов и промежут. в-в методами УФ, ИК и гамма-резонансной спектроскопии, ЭПР, ЯМР, масс-спект-рометрии, хим. поляризации ядер, электрохим. методами и т.п. Разрабатываются способы получения и накопления высокоактивных промежут. продуктов: ионов, радикалов, возбужденных частиц с целью непосредственного изучения их реакц. способности. Для получения констант скорости тех стадий сложной р-ции, в к-рых участвуют высокоактивные частицы, информативно моделирование этих стадий в специальных ("чистых") условиях, напр. путем проведения р-ций при низких т-рах (до 100-70 К), в ионном источнике масс-спектрометра высокого давления, в ячейке спектрометра ион-циклотронного резонанса и т.п. При изучении гетерогенно-каталитич. р-ций важно независимое исследование адсорбции всех участвующих в р-ции в-в на пов-сти катализатора, изучение спектров адсорбир. частиц в оптич. и радиочастотном диапазонах, а также установление их природы физ. и физ.-хим. методами (рентгеновская и УФ фотоэлектронная спектроскопия, оже-спектроскопия, спектроскопия энергетич. потерь электронов и др.).
Элементарные реакции. Для установления механизма реакции привлекают как теоретич. методы (см. Квантовая химия, Динамика элементарного акта), так и многочисленные эксперим. методы. Для газофазных р-ций это - молекулярных пучков метод, масс-спектрометрия высокого давления, масс-спектро-метрия с хим. ионизацией, ионная фотодиссоциация, ион-циклотронный резонанс, метод послесвечения в потоке, лазерная спектроскопия-селективное возбуждение отдельных связей или атомных групп молекулы, в т.ч. лазерно-индуцированная флуоресценция, внутрирезонаторная лазерная спектроскопия, активная спектроскопия когерентного рассеяния. Для изучения механизма реакции в конденсир. средах используют методы: ЭПР, ЯМР, ядерный квадрупольный резонанс, хим. поляризацию ядер, гамма-резонансную спектроскопию, рентгенo- и фотоэлектронную спектроскопию, р-ции с изотопными индикаторами (мечеными атомами) и оптически активными соед., проведение р-ций при низких т-рах и высоких давлениях, спектроскопию (УФ, ИК и комбинационного рассеяния), хемилюминесцентные методы, полярографию, кинетич. методы исследования быстрых и сверхбыстрых р-ций (импульсный фотолиз, методы непрерывной и остановленной струи, температурного скачка, скачка давления и др.). Пользуясь этими методами, зная природу и строение исходных и конечных частиц, можно с определенной степенью достоверности установить структуру переходного состояния (см. Активированного комплекса теория), выяснить, как деформируется исходная молекула или как сближаются исходные частицы, если их несколько (изменение межатомных расстояний, углов между связями), как меняется поляризуемость хим. связей, образуются ли ионные, свободнорадикальные, триплетные или др. активные формы, изменяются ли в ходе р-ции электронные состояния молекул, атомов, ионов.
Напр., квантовохим. расчеты свидетельствуют о том, что в ходе бимолекулярной р-ции между HNCO и СН3ОН по мере уменьшения расстояния с 30 до 10 нм между атомом С группы —NCO и атомом О спирта изменяются заряды qN и qO на атомах N и О группы —N=C=O и заселенности связей PN=C и PC=0. Более резкий темп изменения заряда на N (DqN = 0,47) по сравнению с изменением заряда на О (DqO = 0,18), а также уменьшения заселенности N=С-связи (DPN=C = 0,58) по сравнению со связью С=О (DРC=O = = 0,35) позволяет сделать вывод о преимущественном присоединении гидроксила СН3ОН по связи N=C с образованием уретановой группы —NHC(O)OCH3.
В простых случаях методы квантовой химии позволяют рассчитывать поверхность потенциальной энергии (ППЭ), по к-рой идет р-ция. В более сложных случаях возможно установление только одного из профилей ППЭ, отображающего вид координаты р-ции. Современные расчетные и эксперим. методы позволяют установить более сложное протекание элементарных р-ций, чем это представлялось ранее. Напр., р-ции типа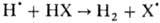 , где X - F или I, могут идти с участием разных электронных состояний частиц:
, где X - F или I, могут идти с участием разных электронных состояний частиц:
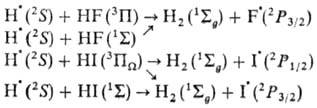
При изучении элементарных р-ций даже простейших частиц методом мол. пучков выявляется наличие неск. каналов протекания р-ции со своими энтальпиями DH0 и сечениями:
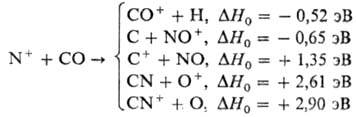
Установлено, что р-ция Не+ + О2  Не + О + О+ идет одновременно по шести каналам с образованием атома О и иона О+ в разных электронных состояниях. Те же результаты были получены методом ион-циклотронного резонанса:
Не + О + О+ идет одновременно по шести каналам с образованием атома О и иона О+ в разных электронных состояниях. Те же результаты были получены методом ион-циклотронного резонанса:
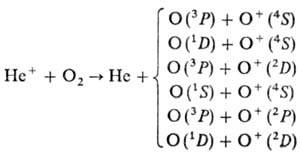
Исследуя картину интенсивности углового рассеяния продуктов в мол. пучках, можно получить прямую микроско-пич. информацию о деталях мол. взаимодействия. Напр., р-ция К +I2 протекает по м е х а н и з м у с р ы в а, когда каждый налетающий на молекулу I2 атом К подхватывает один атом I, двигаясь в прямом направлении, не оказывая при этом сильного воздействия на второй атом I. В предельном случае такого механизма реакции атом I выступает в роли "наблюдателя", т. к. его импульс после акта р-ции остается таким же, как и до него (механизм реакции типа "наблюдатель-срыв"). Однако поведение продукта KI в р-ции К + СН3I существенно отличается от описанного для р-ции К + I2: р-ция К+СН3I осуществляется при столь тесном сближении частиц-партнеров, что продукт KI должен "рикошетировать", как если бы сталкивались твердые шары (м е х а н и з м р и к о ш е т и р о в а н и я). Сближение налетающего атома К с молекулой СН3I наиб. эффективно при конфигурации К...I—СН3, т.е. со стороны йодного конца молекулы ("ориентационный эффект молекулы-мишени"). Для р-ции между атомом щелочного металла М и молекулой галогена Х2 постулируется т. наз. гарпунный механизм, при к-ром от атома М к молекуле Х2 происходит перескок электрона с образованием частиц М+ и Х-2 , к-рые, ускоренно двигаясь друг к другу, взаимод. с образованием колебательно-возбужденного продукта М+Х-. Нередко бимолекулярная р-ция идет в две "микроскопич." стадии с предварит. образованием промежут. комплекса:
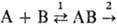
продукты. Напр., р-ции Cs + SF6, Cs + + RbCl идут через образование долгоживущего комплекса сталкивающихся частиц. Это служит указанием на существование на ППЭ вдоль реакц. пути глубокой "ямы". Особенно характерно образование долгоживущих промежут. комплексов для р-ций в р-ре. Напр., р-ция формамида с гидроксид-ионом идет с образованием промежут. тетраэд-рич. комплекса:
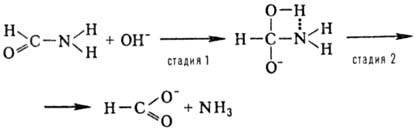
В газовой фазе стадия 1 не имеет энергетич. барьера, стадия 2 обладает таким барьером; в воде обе стадии имеют примерно одинаковые энергетич. барьеры. В этом случае следует говорить о двух элементарных р-циях. Превращение тетраэдрич. комплекса в продукты идет как "концертная р-ция", в ходе к-рой одновременно (в один акт) образуется связь N—Н и разрываются связи О—Н и С—N.
При детальном анализе механизма реакции иногда возникает необходимость в явном виде рассматривать акты переноса энергии между молекулами или с одних энергетич. уровней молекулы на другие. Особенно ярко это проявляется в газофазных р-циях. Напр., мономолекулярная р-ция АВ  А + В может осуществиться только в том случае, если молекула АВ будет обладать внутр. энергией большей, чем энергия активации р-ции. Такие активные молекулы АВ* образуются в результате неупругих столкновений АВ с окружающими молекулами X (термич. активация), а также при облучении светом или при электронном ударе. Элементарная термич. р-ция наряду с собственно хим. превращением (константа скорости k*) должна включать акты активации и дезактивации (константы скорости kа и kд):
А + В может осуществиться только в том случае, если молекула АВ будет обладать внутр. энергией большей, чем энергия активации р-ции. Такие активные молекулы АВ* образуются в результате неупругих столкновений АВ с окружающими молекулами X (термич. активация), а также при облучении светом или при электронном ударе. Элементарная термич. р-ция наряду с собственно хим. превращением (константа скорости k*) должна включать акты активации и дезактивации (константы скорости kа и kд):
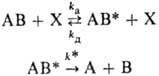
Вследствие увеличения концентрации X с ростом давления данная р-ция имеет второй порядок при малых давлениях и первый порядок при больших давлениях (см. Мономолекулярные реакции). Строго говоря, каждая из приведенных выше р-ций должна описываться системой кинетич. ур-ний, отвечающих микроскопич. актам с участием частиц с разл. заселенностью энергетич. уровней.
Передача энергии с колебательных на электронные уровни молекулы является важной стадией, напр., при взаимод. в основном электронном состоянии 2Р3/2 с колебательно-возбужденной молекулой НСl (колебат. квантовое число u=1):
в основном электронном состоянии 2Р3/2 с колебательно-возбужденной молекулой НСl (колебат. квантовое число u=1):
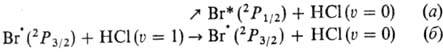
Канал (а)протекания р-ции приводит к резонансному электронно-колебат. обмену энергией, канал (б)-к чисто колебат. дезактивации молекулы. В нек-рых случаях механизм реакции включает в явном виде отвод энергии от образовавшейся в р-ции частицы. Так, рекомбинация атомов и радикалов, напр. 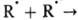 RR, может осуществляться только как три-молекулярная реакция с участием третьей частицы X, отводящей энергию, т. к. иначе выделившаяся при р-ции энергия приведет к диссоциации образовавшейся молекулы RR (
RR, может осуществляться только как три-молекулярная реакция с участием третьей частицы X, отводящей энергию, т. к. иначе выделившаяся при р-ции энергия приведет к диссоциации образовавшейся молекулы RR (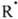 +
+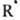 + X
+ X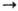 RR + X*). Скорость такой р-ции пропорциональна квадрату концентрации радикалов и общему давлению. В случае рекомбинации многоатомных радикалов энергия р-ции распределяется по мн. степеням свободы и образующаяся молекула приобретает стабильность, а избыточную энергию отдает при послед. столкновениях с др. молекулами. Импульсная ИК лазерная фотохимия позволяет экспериментально решать мн. тонкие вопросы передачи энергии между молекулами и между разными степенями свободы внутри молекулы.
RR + X*). Скорость такой р-ции пропорциональна квадрату концентрации радикалов и общему давлению. В случае рекомбинации многоатомных радикалов энергия р-ции распределяется по мн. степеням свободы и образующаяся молекула приобретает стабильность, а избыточную энергию отдает при послед. столкновениях с др. молекулами. Импульсная ИК лазерная фотохимия позволяет экспериментально решать мн. тонкие вопросы передачи энергии между молекулами и между разными степенями свободы внутри молекулы.
Исп. литература для статьи «МЕХАНИЗМ РЕАКЦИИ»: Бондаренко С. П. Сер. хим.", 1977, № 2, с. 293-99; Денисов Е. Т., Кинетика гомогенных химических реакций, М., 1978; Кондратьев В.Н., Никитин Е. Е., Химические процессы в газах, М., 1981; Индуцируемые лазером химические процессы, под ред. Дж. Стейнфельда, пер. с англ., М., 1983; Эйринг Г., Лин С. Г., ЛинС.М., Основы химической кинетики, пер. с англ., М., 1983; Chandrasekhar J., Smith S. F., Jorgen-sen W.L., "J. Amer. Chem. Soc.", 1985, v. 107, № 1, p. 154-63; Weiner S.J., Singh U. C., Kollman P. A., "J. Amer. Chem. Soc.", 1985, v. 107, № 8, p. 2219-29.
