Сложные реакции
СЛОЖНЫЕ РЕАКЦИИ. Хим. р-ция реализуется как совокупность множества дискретных актов хим. превращения, в каждом из к-рых участвует лишь одна или небольшое число частиц (молекул, атомов, ионов). Если среди актов р-ции имеются химически различающиеся, то р-ция наз. сложной. К сложным реакциям относят наиб. распространенные классы р-ций-каталитические (см. Катализ) и цепные реакции.
Из множества актов сложной реакции можно выделить химически одинаковые; они составляют элементарную р-цию. Сложная реакция представляет собой совокупность элементарных р-ций, природа и последовательность к-рых составляют механизм реакции.
Всякая элементарная р-ция в принципе обратима, т.е. всегда наряду с ней возможна р-ция, отличающаяся лишь направлением превращения (см. Обратимые и необратимые процессы). Совокупность элементарной р-ции и обратной ей в составе сложной реакции наз. стадией сложной реакции. Скорость u-s обратной р-ции м. б. пренебрежимо мала по сравнению со скоростью us прямой р-ции, в таком случае s-ю стадию считают необратимой. Если, напротив, us = u-s (или us ! u-s), s-я стадия равновесна (квазиравновесна, если us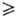 u-s). По характеру взаимосвязи элементарных р-ций выделяют последовательные р-ции (продукт предыдущей элементарной р-ции является исходным в-вом последующей), параллельные р-ции (одновременно протекающие элементарные р-ции, в к-рых по крайней мере одно из исходных в-в общее), последовательно-параллельные р-ции, р-ции с циклич. стадиями и т.п.
u-s). По характеру взаимосвязи элементарных р-ций выделяют последовательные р-ции (продукт предыдущей элементарной р-ции является исходным в-вом последующей), параллельные р-ции (одновременно протекающие элементарные р-ции, в к-рых по крайней мере одно из исходных в-в общее), последовательно-параллельные р-ции, р-ции с циклич. стадиями и т.п.
Согласно детального равновесия принципу, состояние хим. равновесия при сложных реакциях осуществляется таким образом, что каждая стадия строго равновесна. При удалении реагирующей системы от равновесия стадии сложной реакции одна за другой становятся вначале неравновесными, а затем и необратимыми.
Итог сложной реакции передается одним или неск. линейно независимыми хим. ур-ниями (стехиометрич. ур-ниями). В-ва, фигурирующие лишь в хим. ур-ниях стадий сложных реакций, но не в итоговом ур-нии, наз. промежуточными. Итоговое хим. ур-ние сложной реакции может быть получено сложением хим. ур-ний стадий, умноженных на рациональные числа (положит., отрицат. или равные нулю). Эти числа наз. стехиометрич. числами сложных реакций. Набор стехиометрич. чисел, обеспечивающий получение итогового ур-ния (т.е. приводящий к исключению промежут. в-в), задает маршрут р-ции. М.б. образован базис маршрутов, т.е. такая совокупность маршрутов, что они линейно независимы, т.е. любой иной маршрут данной р-ции является линейной комбинацией ее базисных маршрутов. При каждом механизме р-ции число базисных маршрутов определенно, но выбор их в известной мере произволен. Число базисных маршрутов P больше или равно числу Q независимых итоговых ур-ний. Если P > Q, всегда можно выбрать базис маршрутов таким образом, что итоговым ур-нием (Р — Q) базисных маршрутов сложной реакции будет 0 = 0; такие маршруты наз. пустыми, а базис, состоящий из Q непустых маршрутов и (Р — Q) пустых,-стехиометрическим.
Чтобы определить кинетику сложной реакции, т.е. представить скорости ее по итоговым ур-ниям в виде ф-ции концентраций исходных в-в и продуктов, нужно из системы ур-ний, получаемой применением действующих масс закона к элементарным р-циям, исключить неизвестные концентрации промежут. в-в. Эта задача упрощается, если р-ция строго стационарна или если ее с достаточным приближением можно считать квазистационарной: вместо системы дифференц. ур-ний имеем тогда систему алгебраич. ур-ний, все производные концентрации промежут. в-в по времени равны нулю (см. Квазистационарности приближение). С др. стороны, исследуя нестационарную кинетику, можно получить больше информации о механизме сложной реакции, чем если ограничиться лишь стационарной кинетикой.
Условие стационарности сложных реакций записывается в виде:

где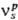 -стехиометрич. число s-й стадии по р-му базисному маршруту, up-сложная реакция по этому маршруту, (us — u-s)-Скорость s-и стадии. Ур-ния вида (1) справедливы для каждой стадии, следовательно, их число равно числу стадий S. К этим ур-ниям м.б. прибавлены линейные ур-ния, связывающие концентрации промежут. в-в. Напр., при гетерог. каталитич. р-ции сумма доли пов-сти, покрытой адсорбир. в-вами, и доли своб. пов-сти равна 1. Такие ур-ния наз. балансовыми, их число W. Число неизвестных скоростей по базисным маршрутам, равное Р, и концентрации промежут. в-в I (считая промежут. в-вом и своб. пов-сть) равно числу ур-ний:
-стехиометрич. число s-й стадии по р-му базисному маршруту, up-сложная реакция по этому маршруту, (us — u-s)-Скорость s-и стадии. Ур-ния вида (1) справедливы для каждой стадии, следовательно, их число равно числу стадий S. К этим ур-ниям м.б. прибавлены линейные ур-ния, связывающие концентрации промежут. в-в. Напр., при гетерог. каталитич. р-ции сумма доли пов-сти, покрытой адсорбир. в-вами, и доли своб. пов-сти равна 1. Такие ур-ния наз. балансовыми, их число W. Число неизвестных скоростей по базисным маршрутам, равное Р, и концентрации промежут. в-в I (считая промежут. в-вом и своб. пов-сть) равно числу ур-ний:

Система ур-ний, к-рые получаем, выразив в (1) us и u-s по закону действующих масс, определяет все неизвестные.
Ур-ние (2) позволяет легко определить число базисных маршрутов данной р-ции. Если к.-л. стадия сложной реакции равновесна, ур-ние (1) в применении к этой стадии заменяется ур-нием, выражающим закон действующих масс для соответствующего равновесия. Для сложной реакции, описываемой неск. итоговыми ур-ниями, достаточно записать кинетич. ур-ния, выражающие скорости по непустым маршрутам стехиометрич. базиса (скорости по пустым маршрутам не требуются, хотя они и не равны нулю).
Альтернативное выражение условий стационарности сложных реакций имеет вид:
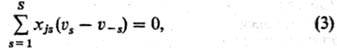
где xjs-стехиометрич. коэф. промежут. в-ва номеру в хим. ур-нии 5-й стадии (положит. число, если в-во образуется, и отрицательное, если в-во расходуется). Условия (1) и (3) эквивалентны, иногда удобнее пользоваться одним, иногда-другим.
В случае одномаршрутной сложной реакции (р-ции с одним базисным маршрутом) ее стационарная скорость u м.б. выражена через скорости в прямом направлении u+ и в обратном направлении u_:

при этом
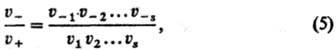
где u1, u2, ...-скорости элементарных р-ций всех стадий. Равенство (5) справедливо независимо от того, каковы стехиометрия, числа стадий. Из него следует, что если хотя бы одна стадия необратима, то u-=0, т.е. Сложная реакция в целом необратима. С помощью изотопных индикаторов можно в ряде случаев определить отдельно u+ и u- .
Если все стадии одномаршрутной сложной реакции, кроме одной (номер l), равновесны, то равенство (5) дает: u-/u+ ! u-l/ul. Тогда, согласно (4), u+ ! ul, u-! u-l. Такую стадию называют скоростьопределяющей или лимитирующей. Если сложные реакции проходит в условиях, близких к равновесным, обычно неравновесна лишь одна стадия, она определяет скорость сложной реакции, если р-ция одномаршрутна. М. И. Темкин.
