Миозин
МИОЗИН (от греч. mys, род. падеж myos-мышца), белок сократит. волокон мышц. Его содержание в мышцах ок. 40% от массы всех белков (в др. тканях и клетках 1-2%). Молекула миозина представляет собой длинный фибриллярный стержень (хвост), несущий на одном конце две глобулярные головки (рис. 1). Длина хвоста ок. 160 нм, диаметр 3 нм.
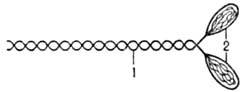
Рис. 1. Схема молекулы миозина: 1-фибриллярный стержень; 2-головки.
Головки имеют грушевидную форму: длина их составляет ок. 20 нм, а толщина-9,5 нм на конце и 5,5 нм в месте прикрепления к стержневой части. Последняя состоит из двух полипептидных цепей с мол. м. ок. 200 тыс. у каждой (т.наз. тяжелые цепи), закрученные спирально одна вокруг другой. В области головок с тяжелыми цепями ассоциированы легкие цепи-субъединицы с мол.м. ок. 20 тыс.; на каждую головку приходится две легкие цепи. Мол.м. всей молекулы составляет ок. 480 тыс.
При расщеплении миозина кратковременным действием трипсина образуются два фрагмента, к-рые наз. легким и тяжелым меромиозинами (обозначаются соотв. LMM и НММ). LMM представляет собой фрагмент стержневой части молекулы миозина длиной ок. 80 нм и с мол.м. 150 тыс. НММ содержит головку миозина и часть хвоста, его длина 60-70 нм, мол. м. ок. 340 тыс. При действии папаином или при длит. воздействии трипсина от молекулы миозина отщепляются головки (т. наз. субфрагменты 1, или S1 с мол. м. 120 тыс. Стержневой фрагмент НММ, к-рый отщепляется при действии папаина, наз. субфрагментом 2 (S2).
N-Концевые части тяжелых цепей миозина располагаются в головках. Особенность аминокислотного состава тяжелых цепей - наличие остатков метилир. аминокислот: 3-метил-гистидина, N6-моно- и N6-триметиллизина. Содержание a-спиралей в головках и хвосте молекулы составляет соотв. 33 и 94%. Тяжелые цепи имеют два гибких "шарнирных" участка: один в основании головки, другой на расстоянии 43 нм от первого.
Миозин обладает АТФазной активностью; катализирует гидролиз АТФ до аденозиндифосфата и Н3РО4 (это св-во миозина открыто В.А. Энгельгардтом и М. Н. Любимовой в 1939). Активный центр АТФазы миозина находится в головках и сохраняет свои каталитич. св-ва при их протеолитич. отщеплении. Существенными для проявления активности являются e-аминогруппа лизина, гуанидиновые группировки аргинина, карбоксильные группы глутаминовой и аспарагиновой к-т.
В мышцах миозин взаимод. с актином с образованием а к т о-м и о з и н о в о г о к о м п л е к с а, играющего важную роль в механизме сокращения мышц. Центр, ответственный за соединение с актином, также находится в головке. Соединение миозина с актином в присут. ионов Mg2+ сопровождается многократным увеличением АТФазной активности. При низкой ионной силе в присут. АТФ происходит р-ция суперпреципитации, в результате к-рой актомиозиновый комплекс сжимается и освобождает воду.
Одно из осн. св-в миозина-его способность при низкой ионной силе агрегировать с образованием хорошо упорядоченных филаментов, подобных тем, в виде к-рых он присутствует в мышце. Нативный филамент миозина представляет собой веретенообразный агрегат диаметром ок. 15 нм и длиной 1500 нм. Хвосты молекул миозина упакованы в глубь филамента, а головки выходят наружу в виде выступов, регулярно расположенных на пов-сти. В центре филамента молекулы миозина агрегированы хвост к хвосту, в результате чего образуется зона, не несущая головок. По обеим сторонам от центра филамента молекулы миозина агрегированы полярно (хвост к голове). Один филамент содержит 300-400 молекул миозина.
В механизме мышечного сокращения важное значение имеют еще два белка-тропомиозин и тропонин. Молекула первого (мол. м. 67 тыс.) полностью построена из a-спиралей и состоит из идентичных по первичной структуре фрагментов, содержащих по 42 аминокислотных остатка. В бессолевой среде тропомиозин полимеризуется, образуя вязкую структуру, обладающую двойным лучепреломлением. При взаимод. с F-актином молекула тропомиозина укладывается в бороздки, образованные двойной спиралью актина. Молекула тропонина представляет собой комплекс, состоящий из трех белков,-тропонина Т (мол. м. 37 тыс.), тропонина I (мол. м. 25 тыс.) и тропонина С (мол. м. 20 тыс.). Тропонин I-ингибитор актомиозиновой Mg-АТФазы, тропонин С способен к связыванию ионов Са2+ , тропонин I связывается с актином, тропонин Т-с тропо-миозином.
Мышечные волокна построены из продольно расположенных фибрилл (миофибрилл) диаметром ок. 1000 нм, в к-рых чередуются светлые и темные диски (соотв. I и А-диски; рис. 2). В середине диска I расположена пластинка Z, к-рая пронизывает все мышечное волокно, удерживая миофибриллы в пучке и упорядочивая их расположение. Участок между двумя соседними пластинками Z (т. наз. c a p к о м е р)- функцией, единица миофибрилл. Внутри миофибрилл находятся два вида филаментов, ориентированных параллельно продольной оси мышцы,-филаменты актина и миозина.
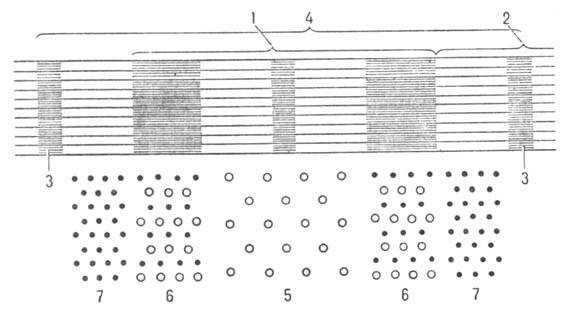
Рис. 2. Схема продольного разреза участка миофибриллы (1 -диск А, 2-диск I, 3-пластинка Z, 4-саркомер); внизу показана схема поперечного среза миофибриллы (5-только нити миозина, 6-нити актина и миозина, 7-только нити актина).
Сокращение мышцы осуществляется в результате скольжения филаментов актина вдоль филаментов миозина (рис. 3) благодаря периодич. присоединению головок миозина к актино-вым филаментам и сгибания молекулы миозина в шарнирных участках (происходит "проталкивание" актиновых филаментов). Расслабление происходит в результате разрыва поперечных контактов миозина и актина и возвращения филаментов в исходное положение.
Такой цикл инициируется поступлением сигнала от нервных окончаний в мышечном волокне, к-рый обусловливает выброс Са2+ из саркоплазматич. ретикулума (сложная система ограниченных мембранами пузырьков, трубочек и т. наз. цистерн, ориентированных вдоль миофибрилл и пронизывающих мышечные волокна). Ионы Са2+ связываются с тропонином С, агрегированным с актином, и вызывают изменение конформации этого белка. В результате этого тропомиозин перемещается в сторону и не препятствует образованию контактов между головками миозина и актином. Когда состояние возбуждения заканчивается, Ca2+-Mg2+-АТФаза саркоплазматич. ретикулума обусловливает обратный поток Са2+ во внутр. пространство ретикулума. Когда концентрация Са2+ достигает достаточно низкого уровня, контакты между головками миозина и актином разрываются и мышечное волокно расслабляется. Необходимая энергия для осуществления этого процесса поступает в результате гидролиза АТФ на миозин.
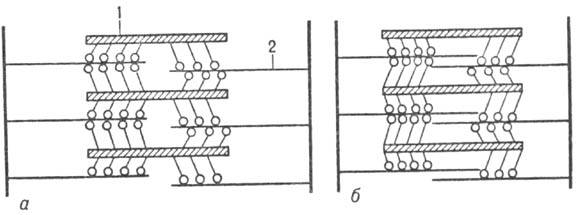
Рис. 3. Схема поперечнополосатой мышцы в покое (а)и при ее сокращении (б); 1 - филаменты миозина; 2 - филаменты актина.
Исп. литература для статьи «МИОЗИН»: Поглазов Б.Ф., Левицкий Д. И., Миозин и биологическая подвижность, М., 1982. Б. Ф. Поглазов.
