Сократительная система
А. Организация скелетных мышц позвоночных
Скелетные поперечнополосатые мышцы позвоночных состоят из параллельных пучков мышечных волокон. Каждое волокно представляет собой одну большую многоядерную клетку. Большую часть объема мышечных клеток занимают миофибриллы толщиной 1-2 мкм, простирающиеся на всю длину мышечного волокна. Поперечная исчерченность, характерная для миофибрилл скелетных мышц, связана с чередованием различных по толщине молекул.
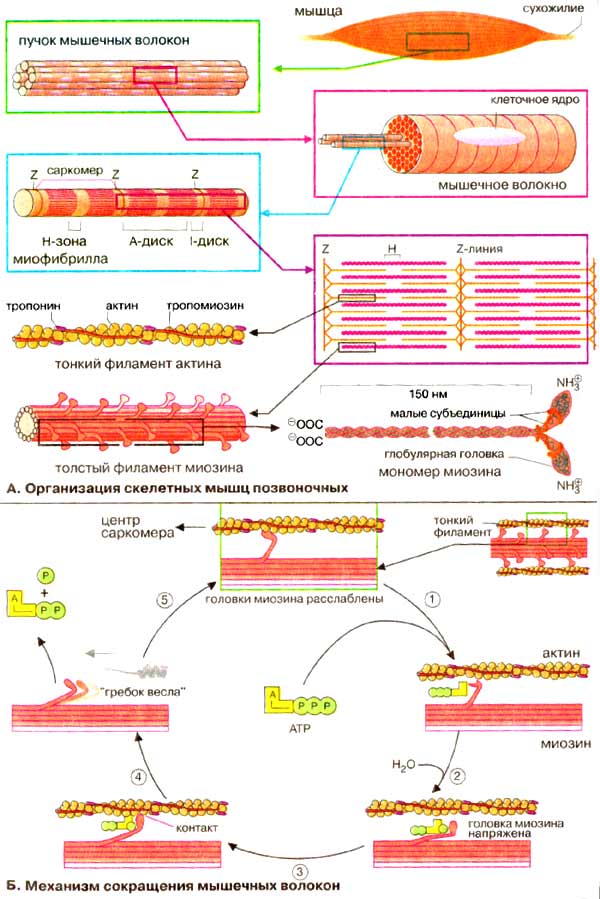
Сократительные элементы, саркомеры, состоят из двух типов параллельных нитей, толстых филаментов миозина и тонких филаментов F-актина. Крайние, более темные области Α-дисков содержат как тонкие, так и толстые нити, тогда как центральная часть, Н-зона, содержит только нити миозина. Z-линии (или Z-пластинки) соответствуют тем участкам, где тонкие нити крепятся к так называемым Z-дискам. Саркомером называется продольная единица, ограниченная двумя Z-линиями.
В количественном отношении наиболее важным белком миофибрилл является миозин (~65% мышечного белка). Молекула миозина построена из шести субъединиц, двух идентичных тяжелых цепей (2 х 223 кДа) и четырех легких цепей (~20 кДа), связанных нековалентно. Каждая тяжелая цепь миозина имеет форму длинного стержня длиной 150 нм с глобулярной головкой на N-конце и напоминает клюшку для гольфа (на схеме внизу справа). α-Спиральные участки двух тяжелых цепей свернуты в двойную суперспираль, а четыре небольших субъединицы связаны с глобулярными головками. В мышечном волокне миозин образует толстые миозиновые филаменты, которые представляют собой пучки из сотен молекул миозина, расположенных параллельно. Головка молекулы миозина обладает Са2+-зависимой АТФ-азной активностью (КФ 3.6.1.32), которая регулируется малыми субъединицами.
Главным белком тонких нитей является актин (42 кДа, ~20-25% мышечного белка). Фибриллярный F-актин является важным структурным элементом цитоскелета; он находится в равновесии с глобулярным G-актином.
Кроме этих двух белков система включает тропомиозин и комплекс тропонина. Нитевидный тропомиозин (64 кДа) связан с F-актином, охватывая примерно семь актиновых субъединиц. Тропонин (78 кДа) - комплекс, состоящий из трех различных субъединиц (Т, С, I), способен связываться как с актином, так и с тропомиозином. Остальные белки, присутствующие в гораздо меньшем количестве, включают α- и β-актинин, десмин, коннектин (титин) и виментин.
Б. Механизм сокращения мышечных волокон
Сокращение мышечных волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов относительно друг друга. Сокращение мышечных волокон является результатом следующего цикла реакций:
1. В отсутствие АТФ (АТР), т. е. в исходном состоянии, головки молекул миозина прочно связаны с актиновыми нитями. При связывании АТФ головки отделяются от актиновых нитей.
2. АТФ-аза головок миозина гидролизует АТФ на АДФ и неорганический фосфат, но продолжает удерживать оба продукта реакции близко друг от друга. Гидролиз АТФ вызывает аллостерические изменения в миозиновой головке.
3. Теперь головка миозина образует новый мостик с соседней молекулой актина.
4. Актин ускоряет выброс продуктов АТФ-азной реакции из активного центра миозина. Это приводит к преобразованию аллостерического напряжения и изменению конформации головки миозина, которое действует подобно «удару весла» (модель весельной лодки). Во время этого «гребка» миозиновые головки отклоняются на определенный угол от оси и перемещают миозиновый филамент вдоль актинового филамента по направлению к Z-диску. Цикл повторяется до тех пор, пока имеется АТФ.
Каждый «гребок» 500 миозиновых головок толстого филамента вызывает смещение на 10 нм. Во время сильных сокращений частота «гребков» составляет примерно 5 раз в секунду. При каждом цикле гидролиза АТФ головки миозина взаимодействуют с новыми молекулами актина, за счет чего и происходит взаимное скольжение миозиновых и актиновых филаментов, т. е. сокращение мышечного волокна.


