Регуляция сокращения мышечных волокон
А. Электромеханическое сопряжение
Сокращением мышечного волокна управляют двигательные нейроны, которые выделяют нейромедиатор ацетилхолин в нервно-мышечные соединении (синапсы). Ацетилхолин диффундирует через синаптическую щель и взаимодействуют с ацетилхолиновыми (холинэргическими) рецепторами плазматической мембраны мышечных клеток. Это вызывает открывание трансмембранных ионных каналов и деполяризацию клеточной мембраны (образование потенциала действия). Потенциал действия быстро распространяется по всем направлениям от нервно-мышечного соединения (см. рис. 341, 343), возбуждая все мышечные клетки. В течение нескольких миллисекунд реализуется рассмотренный выше цикл сокращения мышечного волокна.
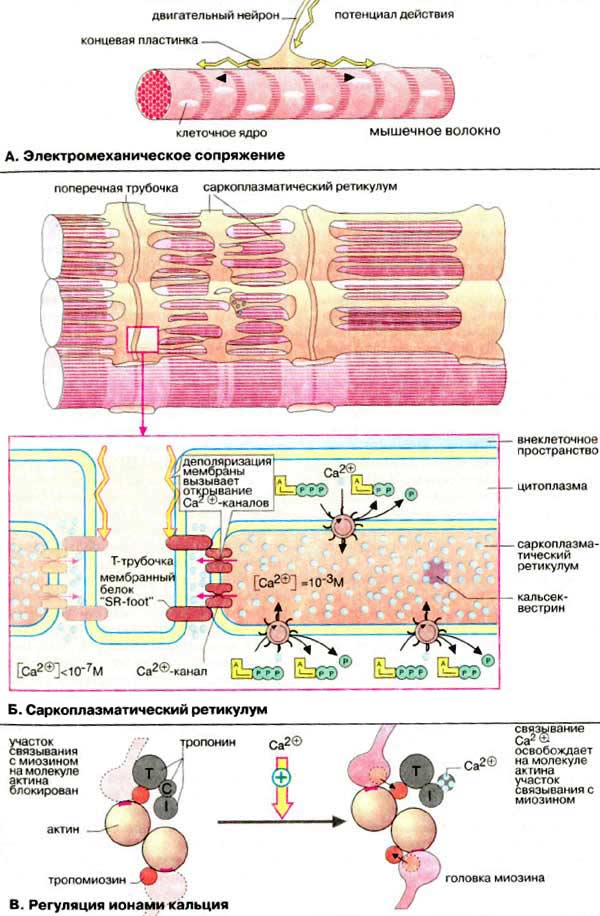
Б. Саркоплазматический ретикулум
Саркоплазматический ретикулум [СР (SR)] -разветвленная подобная эндоплазматическому ретикулуму органелла, окружающая индивидуальные миофибриллы подобно сетке (в верхней части схемы в качестве примера приведен СР клетки сердечной мышцы). В покоящихся клетках концентрация Са2+ очень низка (менее 10-5 М). Однако в саркоплазматическом ретикулуме уровень ионов Са2+ существенно выше (около 10-3 М). Высокая концентрация Са2+ в СР поддерживается Са2+-АТФ-азами. Кроме того, в СР имеется специальный белок кальсеквестрин (55 кДа), который благодаря высокому содержанию кислых аминокислот способен прочно связывать ионы Са2+.
Переносу потенциала действия на СР индивидуальной миофибриллы способствуют поперечные трубочки Т-системы, представляющие трубчатые впячивания клеточной мембраны и находящиеся в тесном контакте с индивидуальными миофибриллами. Деполяризация плазматической мембраны передается через Т-трубочки на потенциал-управляемый мембранный белок (так называемый "SR-foot") прилегающей мембраны СР, который открывает Са2+-каналы. Результатом является выброс ионов Са2+ из СР в пространство между филаментами актина и миозина до уровня ≥10-5 M. В конечном итоге выброс ионов Са2+ является пусковым механизмом процесса сокращения миофибрилл.
В. Регуляция ионами кальция
В расслабленной скелетной мышце комплекс тропонина (субъединицы = Т, С, I) с тропомиозином препятствует взаимодействию миозиновых головок с актином.
Быстрое увеличение в цитоплазме концентрации ионов кальция в результате открывания каналов СР приводит к связыванию Са2+ с С-субъединицей тропонина. Последняя по свойствам близка кальмодулину. Связывание ионов Са2+ вызывает конформационную перестройку в тропонине, тропонинтропомиозиновый комплекс разрушается и освобождает на молекуле актина участок связывания с миозином (на схеме выделен красным цветом). Это инициирует цикл мышечного сокращения (см. с. 324)
В отсутствие последующего стимулирования АТФ-зависимые кальциевые насосы мембраны СР быстро снижают концентрацию ионов Ca2+ до исходного уровня. Как следствие, комплекс Са2+ с тропонином С диссоциирует, тропонин восстанавливает исходную конформацию, место связывания миозина на актине блокируется и мышца расслабляется.
Таким образом, при сокращении мышечного волокна скелетных мышц позвоночных происходит следующая последовательность событий. При поступлении сигнала от двигательного нейрона мембрана мышечной клетки деполяризуется, сигнал передается на Сa2+-каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает. Ионы Сa2+ связывается с тропонином С, вызывая конформационную перестройку в тропонине, что влечет за собой разрушение комплекса тропонин-тропомиозин и дает возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.
По завершении сокращения уровень ионов Са2+ снижается за счет активного обратного транспорта Са2+ в СР, тропонин С отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекуле актина, блокируя актин-миозиновый цикл. Результатом является расслабление мышцы.


