Цитоскелет: состав
Цитоплазма эукариотических клеток пронизана трехмерной сеткой из белковых нитей (филаментов), называемой цитоскелетом. В зависимости от диаметра филаменты разделяются на три группы: микрофиламенты (6-8 нм), промежуточные волокна (около 10 нм) и микротрубочки (около 25 нм). Все эти волокна представляют собой полимеры, состоящие из субъединиц особых глобулярных белков.
А. Актин
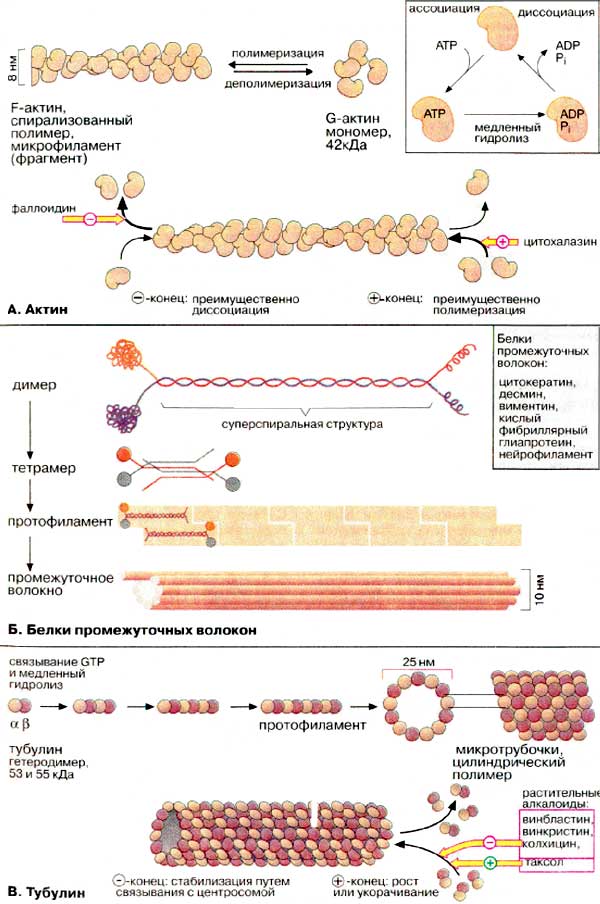
Микрофиламенты (актиновые нити) состоят из актина — белка, наиболее распространенного в эукариотических клетках. Актин может существовать в виде мономера (G-актин, «глобулярный актин») или полимера (F-актин, «фибриллярный актин»). G-актин — асимметричный глобулярный белок (42 кДа), состоящий из двух доменов. По мере повышения ионной силы G-актин обратимо агрегирует, образуя линейный скрученный в спираль полимер, F-актин. Молекула G-актина несет прочно связанную молекулу АТФ (АТР), которая при переходе в F-актин, медленно гидролизуется до АДФ (ADP), т.е. F-актин проявляет свойства АТФ-азы.
При полимеризации G-актина в F-актин ориентация всех мономеров одинакова, поэтому F-актин обладает полярностью. Волокна F-актина имеют два разноименно заряженных конца — (+) и (-), которые полимеризуются с различной скоростью. Эти концы не стабилизированы специальными белками (как, например, в мышечных клетках), и при критической концентрации G-актина (+)-конец будет удлиняться, а (-)-конец укорачиваться. В условиях эксперимента этот процесс может быть ингибирован токсинами грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-концом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к (+)-концу, блокируя полимеризацию.
Актинассоциированные белки. В цитоплазме клеток имеются более 50 различных типов белков, которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции: регулируют объем G-актинового пула (профилин), оказывают влияние на скорость полимеризации G-актина (виллин), стабилизируют концы нитей F-актина (фрагин, β-актинин), сшивают филаменты друг с другом или с другими компонентами (как, например, виллин, α-актинин, спектрин, MARCKS) или разрушают двойную спираль F-актина (гельзолин). Активность этих белков регулируется ионами Са2+ и протеинкиназами.
Б. Белки промежуточных волокон
Структурными элементами промежуточных волокон являются белки, принадлежащие к пяти родственным семействам и проявляющие высокую степень клеточной специфичности. Типичными представителями этих белков являются цитокератины, десмин, виментин, кислый фибриллярный глиапротеин [КФГП (GFAP)] и нейрофиламент. Все эти белки имеют в центральной части базовую стержневую структуру, которая носит название суперспирализованной α-спирали. Такие димеры ассоциируют антипараллельно, образуя тетрамер. Агрегация тетрамеров по принципу "голова к голове" дает протофиламент. Восемь протофиламентов образуют промежуточное волокно.
В отличие от микрофиламентов и микротрубочек свободные мономеры промежуточных волокон едва ли встречаются в цитоплазме. Их полимеризация ведет к образованию устойчивых неполярных полимерных молекул.
В. Тубулин
Микротрубочки построены из глобулярного белка тубулина, представляющего собой димер α- и β-субъединиц (53 и 55 кДа). α, β- Гетеродимеры образуют линейные цепочки, называемые протофиламентами. 13 протофиламентов образуют циклический комплекс. Затем кольца полимеризуются в длинную трубку. Как и микрофиламенты, микротрубочки представляют собой динамические полярные структуры с (+)- и (-)-концами. (-)-Конец стабилизирован за счет связывания с центросомой (центр организации микротрубочек), в то время как для (+)-конца характерна динамическая нестабильность. Он может либо медленно расти, либо быстро укорачиваться. Тубулиновые мономеры связывают ГТФ (GTP), который медленно гидролизуется и ГДФ (GTP). С микротрубочками ассоциируют два вида белков: структурные белки (MAP от англ. microtubuls-associated proteins) и белки-транслокаторы.


