Основания органические
ОСНОВАНИЯ ОРГАНИЧЕСКИЕ, орг. соед., используемые на практике в качестве акцепторов протонов. К ним относят нейтр. основания (третичные амины, амидины) и анионные основания [алкоголяты и алтсил(или арил)амиды щелочных металлов, металлоорг. соед.]. К специфич. типам оснований органических относят также ангидрооснования (см. Кислоты и основания)и псевдооснования. Основания органические применяют прежде всего для ионизации соед. по связям О—Н, N—Н, С—Н. Ионизирующая способность оснований органических характеризуется константой ионизации сопряженной к-ты рКа (см. табл.). Важное преимущество их перед щелочами - р-римость в орг. р-рителях, что позволяет применять основания органические в неводных средах.
КОНСТАНТЫ ИОНИЗАЦИИ НЕКОТОРЫХ ОРГАНИЧЕСКИХ ОСНОВАНИЙ В ВОДНОМ РАСТВОРЕ ПРИ 25 °С
| Соединение | Ф-ла | рк. | ||
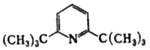
| 2,6-Ди-трет-бутилпиридин | | 4,95 | ||
| N,N-Диметиланилин | С6Н5N(СН3)2 | 5,10 | ||
| C5H5N | 5,23 | |||
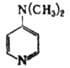
| 4-Диметиламинопиридин | | 9,37 | ||
Продолжение табл.
| Соединение Триэтиламин | Ф-ла (C2H5)3N | рка 10,67 | ||
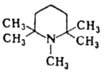
| 1,2,2,6,6-Пентаметилпиперидин | | 11.25 | ||
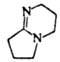
| 1,5-Диазабицикло [4.3.0]нон-5-ен (ДБН) | | ~12 | ||
| CH3ONa | ~16 | |||
| C2H5ONa | ~18 | |||
| трет-Бутилат калия | трет-C4H9OK | ~19 | ||
| Диизопропиламид лития | [(CH3)2CH]2NLi | ~35 | ||
| C4H9Li | ~40 42 | |||
Третичные амины относят к мягко действующим основаниям, в отличие от щелочей они не вызывают гидролиза сложноэфирных связей или лабильных связей С—Hal. Напротив, у анионных оснований ионизирующая способность намного сильнее, чем у щелочей.
Широкое применение в орг. синтезе находит триэтиламин. Так, ацилирование 1-метилимидазола в его присут. протекает в положение 2. Роль триэтиламина заключается в ионизации связи С-2—Н в катионе 1-ацил-3-метилимидазо-лия. что обеспечивает перенос ацильной группы к атому С-2:
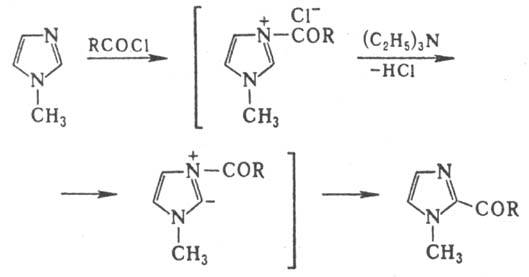
При О-ацилировании фенолов для ионизации связи О—Н используют пиридин или его 4-диметиламинопроизводное; напр., в присут. последнего ацетилируется мезитол:
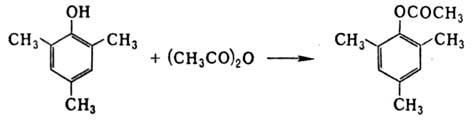
Для дегидрогалогенирования соед., содержащих чувствительные к щелочам и др. сильным основаниям группировки, применяют ДБН, к-рый, напр., превращает хлорацетилены, содержащие сложноэфирную группировку, в сопряженные енины:
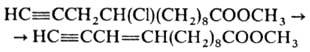
Для изомеризации ацетиленов с неконцевой тройной связью в ацетилены с концевой тройной связью используют 3-аминопропиламид калия NH2CH2CH2CH2NHK:
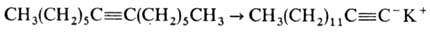
Все большее применение находят т. наз. пространственно-затрудненные основания органические, напр. 2,6-ди-трет-бутилпиридин, пента-метилпиперидин и др. Благодаря экранированию оснбвного центра алкильными группами, они практически не проявляют нуклеоф. св-в, т.е. не взаимод. с льюисовскими кислотными центрами (положительно заряженными атомами углерода, ионами металлов и т. п.), но сохраняют способность присоединять протон. Так, пентаметилпиперидин [C5H6N(CH3)5], полностью лишенный способности алкили-роваться, с успехом используется для связывания галогено-водорода при исчерпывающем алкилировании алкилами-нов:
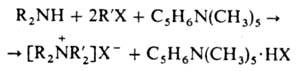
Пространственно-затрудненные этилдициклогексиламин и этилдиизопропиламин (основания Хюнига) рекомендовано использовать для превращ. a-галогенир. простых эфиров в винилалкиловые эфиры (выход > 80%):
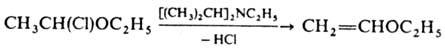
Нек-рые основания органические, получившие назв. протонных гарпунов, обладают уникальной способностью ионизировать слабые к-ты по связям С—Н, не затрагивая при этом др. лабильные группы. Так, под действием диизопропиламида Li 4,6-ди-хлорпиримидин подвергается не нуклеоф. замещению подвижных атомов Сl, а металлированию:
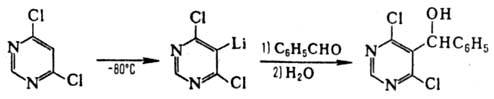
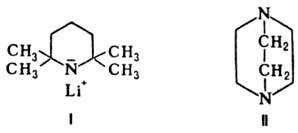
Аналогично действие тетраметилпиперидида Li (ф-ла I), к-рый металлирует сложные эфиры карбоновых к-т, содержащих  -Н-атом, не затрагивая сложно-эфирную группировку:
-Н-атом, не затрагивая сложно-эфирную группировку:
; 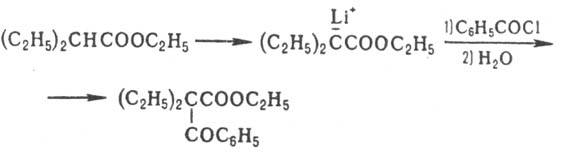
Основания органические иногда используют для активации металлоорг. соединений. Напр., активность бутиллития значительно повышается в присут. 1,4-диазабицикло[2.2.2]октана (ДАБЦО; II) или тетраметилэтилендиамина (ТМЭДА), что объясняется координацией N-атомов этих соед. с ионом лития, к-рый таким образом отделяется от карбаниона и не так сильно нейтрализует его отрицат. заряд.
См. также Алкоголяты, 1,8-бис-(Диметиламино)нафталин, Металлоорганические соединения.
Лит.: Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т. 1-7, М., 1970-78; Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 53-77; Каnnег В., "Heterocycles", 1982, v. 18, special issue, p. 411-19.
А. Ф. Пожарский.