Химические реакции
I. Реакции карбоксильной группы. 1. Образование солей с основаниями. Подобно алифатическим кислотам, аминокислоты образуют соли с основаниями.
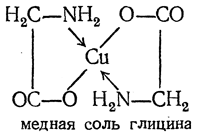
Кроме обычных солей, они в известных условиях могут образовывать внутрикомплексные соли с катионами металлов. Очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные соли аминокислот с медью:
2. Образование эфиров. Действием на аминокислоты спирта и хлористого водорода получаются эфиры аминокислот:

Очень удобно проводить этерификацию аминокислот в присутствии хлористого тионила:
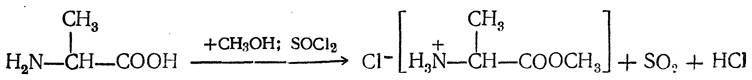
Метиловые и этиловые эфиры аминокислот — жидкости, легко перегоняющиеся в вакууме. Поэтому они были использованы для разделения смесей аминокислот (Э. Фишер).
Большое значение получили бензиловые эфиры аминокислот, применяемые в синтезе пептидов. Их получают действием бензилового спирта на аминокислоту в присутствии НСl или n-толуолсульфокислоты как катализатора;
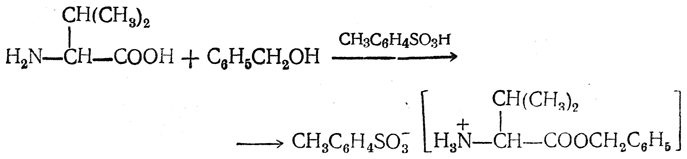
Эфиры аминокислот под действием аммиака или аминов легко превращаются в соответствующие амиды
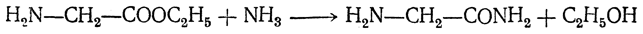
при обработке гидразином образуют гидразиды:
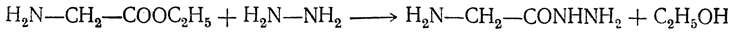
Действуя на гидразиды ацилированных аминокислот азотистой кислотой, можно получить азиды ациламинокислот

применяемые в синтезе пептидов.
При действии литийалюминийгидрида эфиры аминокислот восстанавливаются до аминоспиртов.
3. Образование галоидангидридов. При взаимодействии с пятихлористым фосфором аминокислоты образуют галоидангидриды:
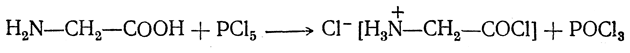
Они крайне неустойчивы и существуют только в виде солей. Более устойчивы применяемые в синтезе пептидов галоидангидриды ацилированных аминокислот:
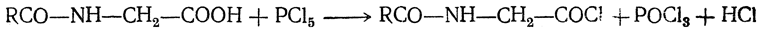
4. Д ек ар б о к си л и р о в а н и е. При отщеплении от аминокислот карбоксильной группы образуются амины:
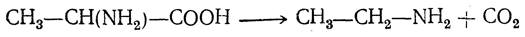
II. Реакции аминной группы. 1. Образование солей с кислотами. С минеральными кислотами аминокислоты подобно аминам дают соли.
2. Действие азотистой кислоты. При действии азотистой кислоты образуется оксикислота и выделяются азот и вода:
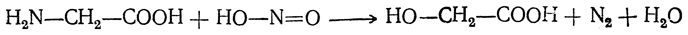
Этой реакцией пользуются для количественного газометрического определения аминогрупп в аминокислотах, а также в белках и продуктах их распада (метод Ван-Сляйка).
Эфиры α-аминокислот образуют с азотистой кислотой стойкие и реакционноспособные диазосоединения.
3. Образование N-a ц и л и р о в а н н ы х производн ы х. Аминокислоты реагируют с хлорангидридами и ангидридами кислот, образуя N-ацилированные производные. Реакция проходит до конца только в водно-щелочных или неводных средах, так как во взаимодействие вступает аминная, а не аммонийная группа:
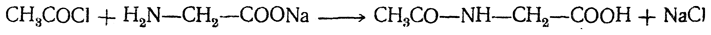
N-Ацилированные производные аминокислот имеют большое применение при синтезе пептидов.
Некоторые ацилированные аминокислоты имеют биологическое значение. С их образованием связано обезвреживание ядовитых веществ, всасывающихся в кровь из кишечника. Так, например, ядовитая бензойная кислота связывается глицином и удаляется из организма с мочой в форме гиппуровой кислоты:
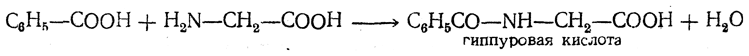
4. Получение N-aлкилированных производн ы х. При действии галоидных алкилов, алкилсульфатов или диазометана на аминокислоты получаются моно- или ди-N-алкилзамещенные, называемые также вторичными и третичными аминокислотами. При дальнейшем алкилировании могут получаться четвертичные аммониевые основания. Их внутренние соли носят название бетаинов.
5. Получение N-a рилированных производных. Большое значение приобрели 2,4-динитрофенильные N-производные аминокислот, которые применяются для характеристики и количественного определения аминокислот, а также для исследования строения пептидов и белков. Эти производные получаются при взаимодействии аминокислот с 2,4-динитрофторбензолом в щелочной среде:
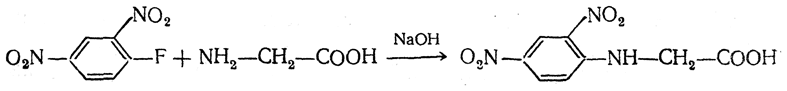
Так как в нитро- и динитробензолах в о- и п-положениях электронная плотность понижена (см. правила замещения в бензольном ядре), приведенная выше динитрофенильная группировка обладает ярко выраженными электроноакцепторными свойствами. Поэтому она оттягивает свободную электронную пару от атома азота, лишая его основных свойств. Этим объясняется тот факт, что в отличие от аминокислот динитрофениламинокислоты не амфотерны и хорошо растворимы в органических растворителях. Для N-(2,4-динитрофенил)-аминокислот характерна яркая желтая окраска и способность поглощать свет в ультрафиолетовой части спектра.
6. Получение аралкиламинокислот. При действии трифенилхлорметана в слабощелочной среде аминокислоты дают N-трифенилметильные («тритильные») производные:
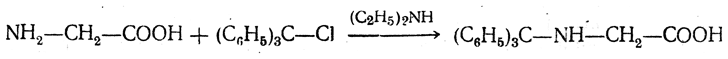
Основные свойства аминогруппы в таких соединениях заметно ослаблены, а связь С—N сравнительно непрочна. Поэтому они легко гидролизуются при нагревании с разбавленной уксусной кислотой:
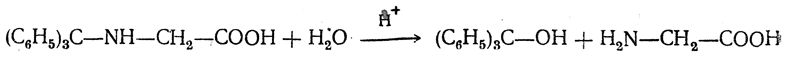
Эта особенность N-(трифенилметил)-аминокислот обусловила их использование в пептидном синтезе.
7. Взаимодействие с альдегидами. Аминокислоты легко реагируют с альдегидами. При взаимодействии с формальдегидом образуются N-монооксиметил аминокислоты и N,N-диоксиметиламинокислоты:
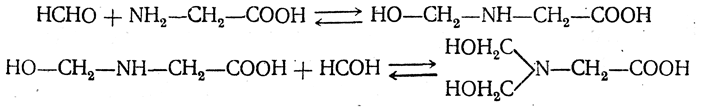
Эти производные титруются как алифатические кислоты, что используется для количественного определения аминокислот (Серенсен). При восстановлении N,N-диоксиметиламинокислот получаются N,N-диметиламинокислоты.
8. Взаимодействие с кетокислотами. α-Аминокислоты реагируют с кетокислотами при нагревании в водных растворах. В первой стадии реакции образуется нестойкое иминопроизводное
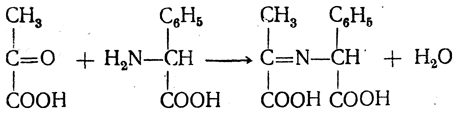
в котором затем происходит перемещение двойной связи, причем одновременно отщепляется двуокись углерода и мигрирует, атом водорода:
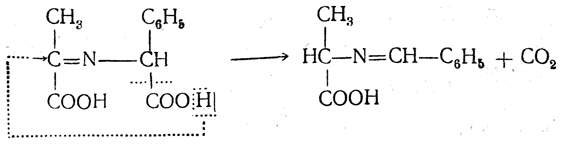
После гидролиза образуется новая аминокислота и альдегид:
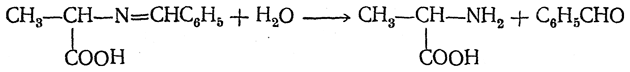
В 1937 г. А. Н. Браунштейн и М. Г Крицман открыли происходящую в организме животных реакцию, получившую название реакции переаминирования. В результате этой реакции, протекающей по более сложному механизму, чем рассмотренный выше, аминогруппа переходит от α-аминокислоты к кетокислоте:
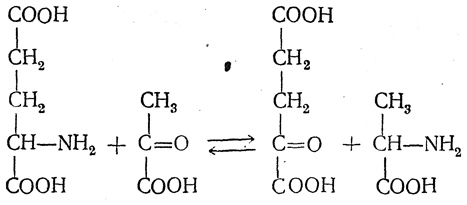
Реакции переаминирования принадлежит большая роль в процессах обмена аминокислот в природе.
9. Окислительное дезаминирование. Аминокислоты под влиянием многих окислителей, таких, как гипохлориты, хлорамин Т, персульфаты, отщепляя аммиак, превращаются в соответствующие кетокислоты:
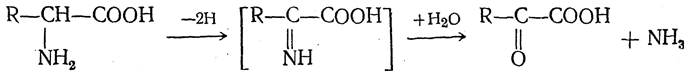
Эта реакция, получившая название окислительного дезаминирования, протекает в организме животных под влиянием специфических ферментов.
10. Нингидринная реакция. В качестве реактива для качественного и количественного определения аминокислот широко применяется нингидрин (трикетогидринденгидрат). При нагревании с аминокислотой нингидрин восстанавливается до дикетооксигидриндена, а аминокислота окисляется и распадается на альдегид, двуокись углерода и аммиак:
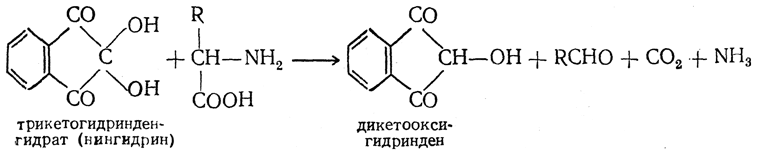
Выделившийся аммиак конденсируется с молекулой образовавшегося дикетооксигидриндена и со второй молекулой нингидрина:
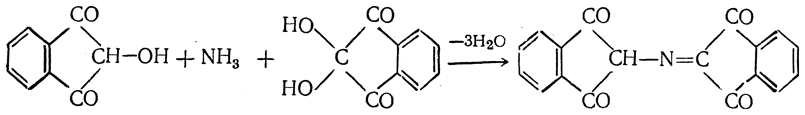
Аммонийная соль енольной формы образовавшегося соединения
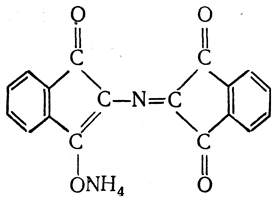
благодаря наличию системы сопряженных двойных связей окрашена в интенсивный сине-фиолетовый цвет. По интенсивности окрашивания можно определить содержание аминокислоты в растворе. Иногда для этой цели измеряют количества двуокиси углерода, альдегида или аммиака, выделившихся при реакции с нингидрином.
Необходимо иметь в виду, что окрашивание с нингидрином дают не только аминокислоты, но также пептиды, первичные и вторичные амины.
III. Реакции, протекающие с одновременным участием карбоксильной и аминной групп. 1. Превращения аминокислот при нагревании. α-Аминокислоты, а еще легче их эфиры, при нагревании образуют циклические пептиды — дикетопиперазины:
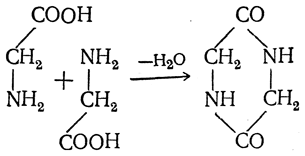
β-Аминокислоты при нагревании образуют α,β-ненасыщенные кислоты с отщеплением аминогруппы и водорода от соседних атомов углерода:
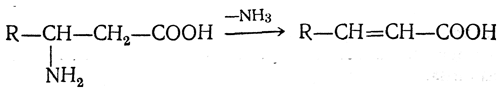
γ-, δ- и ε-Аминокислоты, как и соответствующие оксикислоты, легко отщепляют воду и циклизуются, образуя внутренние амиды — лактамы:
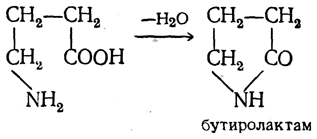
Известны и β-лактамы, соответствующие β-аминокислотам. В частности, β-лактамное кольцо имеется в молекуле антибиотика пенициллина. Однако синтетическое получение β-лактамов сопряжено с большими трудностями.
2. Образование гидантоинов. α-Аминокислоты реагируют с мочевиной. Эта реакция проходит с участием аминной и карбоксильной групп и приводит к образованию гидантоинов:
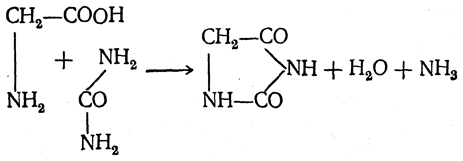
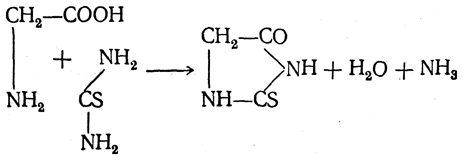
При взаимодействии аминокислот с тиомочевиной образуются аналогично построенные тиогидантоины: