Трифенилхлорметан
ТРИФЕНИЛХЛОРМЕТАН (трифенилметилхлорид, тритилхлорид) (C6H5)3CCl, мол. м. 278,8; бесцв. кристаллы гексагон. сингонии (а =1,39 нм, с = 0,131 нм, z = 6); т.пл. 115 0C, т. кип. 310 0C, 230-235 °С/20 мм рт. ст.; С°р 123,3 Дж/(моль·К) (644,3 К); 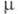 6,59-10-30 Кл·м; хорошо раств. в диэтиловом эфире, хлороформе, бензоле, хуже - в ацетоне.
6,59-10-30 Кл·м; хорошо раств. в диэтиловом эфире, хлороформе, бензоле, хуже - в ацетоне.
Трифенилхлорметан в р-ре жидкого SO2 диссоциирует на сольватир. карбкатион желтого цвета и анион:
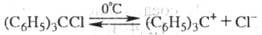
Ионизация трифенилхлорметана происходит также в пиридине, р-ре SbCl5, SnCl4, H2SO4. При взаимод. с нек-рыми металлами (напр., Hg, Ag или Zn) в бензоле без доступа O2 трифенилхлорметан образует устойчивый трифенилметильный радикал (C6H5)3C0, находящийся в равновесии с димером: в присут. O2 превращ. в трифенилметилпероксид (C6H5)(COOC(C6H5)3. Р-ция трифенилхлорметана с амидом Na или амальгамой Na в диэтиловом эфире приводит к образованию темно-красного р-ра трифенилметилнатрия (тритилнатрия):

Трифенилхлорметан легко вступает в р-ции нуклеоф. замещения, что обусловлено образованием устойчивого трифенилметильнго карбкатиона. В присут. Na2CO3 легко гидролизуется до трифенилкарбинола. При взаимод. с первичными спиртами ROH при 20-25 0C в присут. пиридина с высоким выходом превращ. в простые тритиловые эфиры (C6H5)3COR: с солями орг. к-т - в сложные (C6H5)COOR: с NH3, аминами и гидразином - в соответствующие N-тритильные производные. Эти р-ции применяют в орг. химии для защиты первичных спиртовых групп в сахарах или аминогрупп в аминокислотах.
Осн. методы получения трифенилхлорметана взаимод. бензола с CCl4 в присут. AlCl3 по р-ции Фриделя - Крафтса, нагревание трифенилметана с PCl5, взаимод. трифенилкарбинола с конц. HCl, PCl3 или CH3COCl в бензоле, напр.:

Производные трифенилхлорметана применяют в качестве красителей (см. Арилметановые красители).
Лит.: Физер Л., Физер M., Органическая химия, пер. с англ.. 2 изд., т. 1, M., 1970; Робертс Д., Kaсерио M., Основы органической химии, пер. с англ., т. 2, M., 1978; Chemistry of carbon compounds, ed. by E. II. Rodd, v. 3, pt B, Amst.-[а.о.], 1956, p. 1087. С. И. Диденко.
