Амидины
АМИДИНЫ, производные карбоновых к-т общей ф-лы RC(r=NR')NR"R"', где R, R', R", R'"-H или орг. остаток. Сильные основания. В своб. виде многие неустойчивы и используются в виде солей. Так, формамидин НС(—NH)NH2 известен только в виде гидрохлорида (т. пл. 80°С), ацетамидин CH3C(=NH)NH2 - в виде гидрохлорида (т. пл. 166-167°С), бензамидин C6H5C(=NH)NH2 - в виде основания, гидрохлорида и его дигидрата (т. пл. 75-80, 169 и 72°С соотв.).
N-Моно- и N,N'-дизамещенные амидины могут существовать в двух таутомерных формах: RC(—NR')NHR"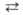 RC(=NR")NHR'. Они довольно легко гидролизуются в кислой и щелочной средах до амидов. Могут подвергаться переаминированию с образованием других амидинов (в приведенном ниже ур-нии R" = Alk или Аг), амидразонов (R"= NHR'") и амидоксимов (R" = OH): RC(=NH)NHR' + R"NH2 -> RC(=NR")NHR'.
RC(=NR")NHR'. Они довольно легко гидролизуются в кислой и щелочной средах до амидов. Могут подвергаться переаминированию с образованием других амидинов (в приведенном ниже ур-нии R" = Alk или Аг), амидразонов (R"= NHR'") и амидоксимов (R" = OH): RC(=NH)NHR' + R"NH2 -> RC(=NR")NHR'.
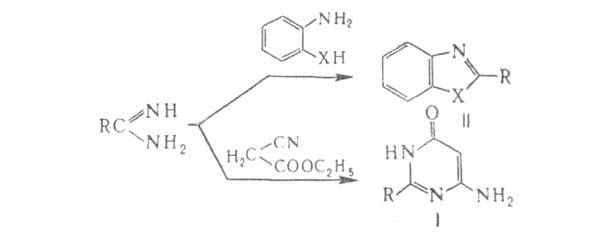
Амидины используют для синтеза гетероциклич. соединений. Так, при взаимод. амидинов с производными малонового или циануксусного эфира,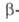 дикетонами, енаминокетонами образуются замещенные пиримидины (ф-ла I), с о-аминофенолом-бензоксазолы (II; X = О), с о-фенилендиамином-бензимидазолы (II; X = NH):
дикетонами, енаминокетонами образуются замещенные пиримидины (ф-ла I), с о-аминофенолом-бензоксазолы (II; X = О), с о-фенилендиамином-бензимидазолы (II; X = NH):
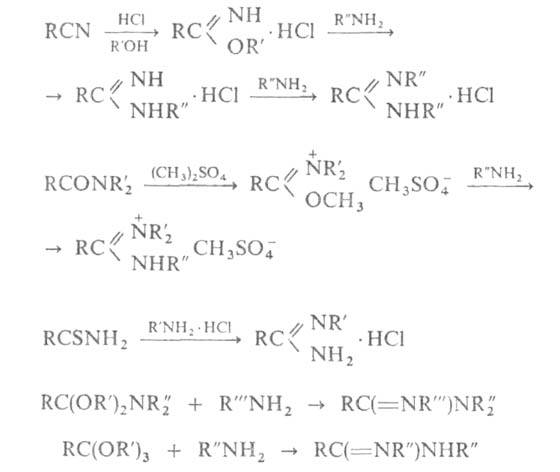
Амидины получают обычно из нитрилов, амидов, тиоамидов и др. производных карбоновых к-т по р-циям:
Ряд амидинов обладает высокой биол. активностью. Амиди-новый фрагмент (обычно в составе гетероцикла) входит в структуру мн. лек. препаратов, напр. нафтизина, галазолина, фентоламина, хлордиазепоксида.
Литература
Граник В. Г., "Успехи химии", 1983, т. 52, в. 4, с. 669-702; Mohre H., Schriftenr. Bundesapothekerkammer Wis. Fortbild. Gelbe Reihe, Bd 2. 1974. S. 233: Chemistry of amidines and imidates, ed. by S. Patai, L.-[a.o.], 1975. В. Г. Граник.
