Натрия пероксид
НАТРИЯ ПЕРОКСИД Na2O2, бесцв. кристаллы, техн. натрия пероксид слабо-желтого цвета из-за примеси NaO2. До 512°С существует b-Na2O2 с гексагон. кристаллич. решеткой (а= 0,6208 нм, с = 0,4469 нм, z = 3, пространств. группа Р62т), выше 512°С устойчив a-Na2O2, DH перехода a<=>b 5,36 кДж/моль; плотн. 2,61 г/см3; C0p 89 ДжДмоль•К); DH0пл 17кДж/моль, DH0обр -512 кДж/моль; S0298 94 ДжДмоль• К). Натрия пероксид начинает терять кислород при 311-400 °С, бурно разлагается при 540 °С. Раств. в воде с образованием NaOH, H2O2 и О2. Образует кристаллогидраты Na2O2.nH2O, где п = 2,4,8, Na2O2.2H2O2.4H2O. С влагой воздуха и СО2 реагирует, давая NaOH, Na2CO3 и О2, с N2O4 при 20°C-NaN03, с NO-NaNO2, с SO2-Na2SO4. Натрия пероксид- сильный окислитель.
Получают натрия пероксид окислением расплавл. Na кислородом воздуха, очищенного от СО2 и высушенного. Применяют натрия пероксид для регенерации воздуха (Na2O2 + CO2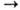 Na2CO3 + + 1/2О2) в подводных лодках и дыхат. приборах изолирующего типа, водные р-ры-для отбеливания бумаги, тканей, целлюлозы; в аналит. химии-для перевода тугоплавких оксидов в растворимое состояние путем сплавления с натрия пероксидом.
Na2CO3 + + 1/2О2) в подводных лодках и дыхат. приборах изолирующего типа, водные р-ры-для отбеливания бумаги, тканей, целлюлозы; в аналит. химии-для перевода тугоплавких оксидов в растворимое состояние путем сплавления с натрия пероксидом.
Натрия пероксид огнеопасен в присут. орг. в-в.
Лит.: Вольное И. И., Пероксидные соединения щелочных металлов, М., 1980.
Е.В. Савинкипа.
