Методы выделения и анализа белков
Препараты высокоочищенных белков находят разнообразное применение в научных исследованиях, медицине и биотехнологии. Так как многие белки, и в особенности глобулярные, высоколабильны, выделение проводят с помощью предельно мягких методов и при пониженной температуре (0-5°С). К таким методам относится ионообменная хроматография, которая обсуждалась на с. 68. Другие методы выделения белков представлены в этом разделе.
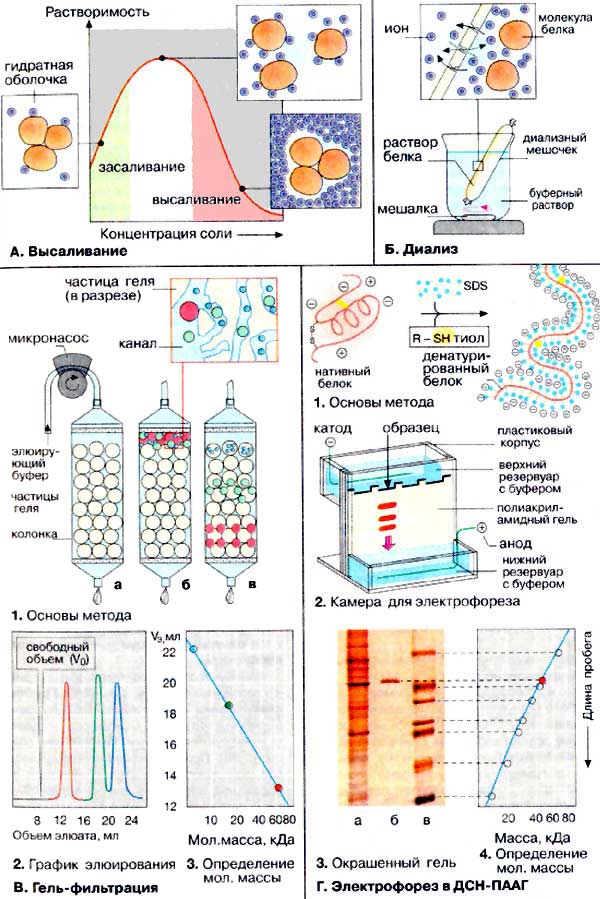
A. Высаливание
Растворимость белков сильно зависит от концентрации солей (от ионной силы). В дистиллированной воде белки чаще всего растворяются плохо, однако их растворимость возрастает по мере увеличения ионной силы. При этом все большее количество гидратированных неорганических ионов (светло-синие кружочки) связывается с поверхностью белка и тем самым уменьшается степень его агрегации (засаливание). При высокой ионной силе молекулы белков лишаются гидратирующих оболочек, что приводит к агрегации и выпадению белка в осадок (высаливание). Используя различие в растворимости, можно с помощью обычных солей, например (NН4)2SО4, разделить (фракционировать) смесь белков.
Б. Диализ
Для отделения низкомолекулярных примесей или замены состава среды используют диализ. Метод основан на том, что молекулы белка из-за своих размеров не могут проходить через полупроницаемые мембраны, в то время как низкомолекулярные вещества равномерно распределяются между объемом, ограниченным мембраной, и окружающим раствором. После многократной замены внешнего раствора состав среды в диализном мешочке (концентрация солей, величина pH и др.) будет тот же, что и в окружающем растворе.
B. Гель-фильтрация
Гель-проникающая хроматография (гель-фильтрация) позволяет разделять белки по величине и форме молекул. Разделение проводят в хроматографических колонках, заполненных сферическими частицами набухшего геля (размером 10-500 мкм) из полимерных материалов (1а). Частицы геля проницаемы благодаря внутренним каналам, которые характеризуются определенным средним диаметром. Смесь белков (1б) вносят в колонку с гелем и элюируют буферным раствором. Белковые молекулы, не способные проникать в гранулы геля (помечены красным цветом), будут перемещаться с высокой скоростью. Средние (зеленого цвета) и небольшие белки (синего цвета) будут в той или иной степени удерживаться гранулами геля (1в). На выходе колонки элюат собирают в виде отдельных фракций (2). Объем выхода того или иного белка зависит в основном от его молекулярной массы (3).
Г. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия
В настоящее время электрофорез в полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) [ДСН-ПААГ-электрофорез (SDS-PAGE)] является общепринятым методом определения гомогенности белковых препаратов. Метод основан на свойстве заряженных частиц (молекул) перемещаться под действием электрического поля. Обычно скорость миграции зависит от трех параметров анализируемых белков: величины молекул, формы молекул и суммарного заряда. Поэтому предварительно белки денатурируют с тем, чтобы скорость миграции зависела только от молекулярной массы. Для этого анализируемую смесь обрабатывают додецилсульфа-том натрия [ДСН (SDS)] (C12H25OSO3Na), который представляет собой детергент с сильно выраженными амфифильными свойствами. Под действием ДСН олигомерные белки диссоциируют на субъединицы и денатурируют. Развернутые полипептидные цепи связывают ДСН (примерно 0,4 г/г белка) и приобретают отрицательный заряд. Для полной денатурации в среду добавляют тиолы, которые расщепляют дисульфидные мостики (1).
Электрофорез проводят в тонком слое полиакриламида (2). После завершения электрофореза, зоны белков выявляют c помощью красителя, В качестве примера на схеме 3 приведена электрофореграмма трех препаратов: клеточного экстракта, содержащего сотни белков (а); выделенного из экстракта гомогенного белка (б); контрольной смеси белков с известными молекулярными массами (в).


