Изомеразы
ИЗОМЕРАЗЫ, класс ферментов, катализирующих р-ции изомеризации. Подклассы изомераз (их пять) сформированы по типам р-ций, а подподклассы по типам субстратов. Рацемазы и эпимеразы катализируют соотв. рацемизацию и эпимеризацию в-в. Субстраты рацемаз содержат один хиральный центр, эпимераз несколько. У исследованных рацемаз a-аминокислот кофермент пиридоксальфосфат. В ходе р-ции a-аминокислоты с пиридоксальфосфатом (ф-ла I, здесь и ниже Р - остаток фосфорной к-ты) образуется шиффово основание (II), к-рое переходит в хиноидную форму (III):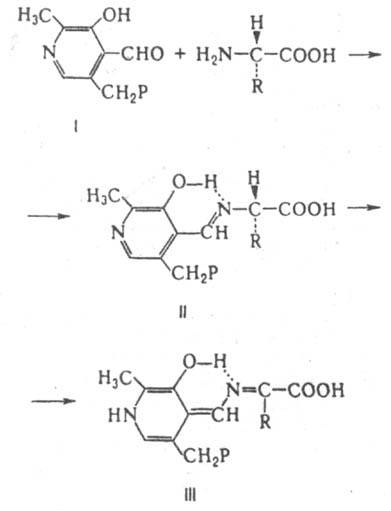
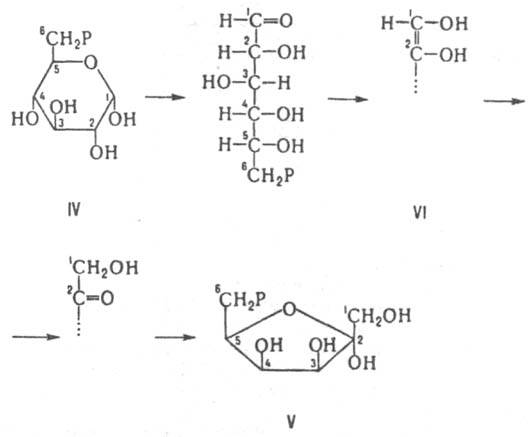
Рацемизация a-аминокислоты обусловлена обратной р-цией нестереоспецифич. присоединения Н+ к атому С, связанному с R. Рацемазы аминокислот играют существенную роль у бактерий, синтезирующих из L-изомеров D-аланин и D-глутаминовую к-ту, необходимые для синтеза пептидогликанов. Среди др. изомераз, катализирующих превращения аминокислот, хорошо изучена диаминопимелинатэпимераза, катализирующая превращение 2,6-L,L-диаминопимелиновой к-ты в мезо-форму. В группе эпимераз, катализирующих превращения углеводов, наиб. изучена альдоза-1-эпимераза, участвующая во взаимопревращении a- и b-моносахаридов, а также уридиндифосфатглюкоза-4-эпимераза, катализирующая эпимеризацию углевода в положении 4 с образованием уридиндифосфатгалактозы.
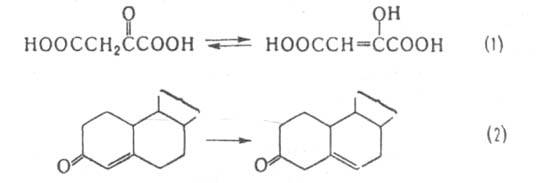
К этой же группе относятся ферменты, катализирующие кетоенольные превращ. (напр., оксалоацетат-таутомераза, участвующая в р-ции 1), а также перемещение двойной связи (напр., стероид-D-изомераза, катализирующая р-цию 2) и связи S-S в белках (белок дисульфид-изомеразы):
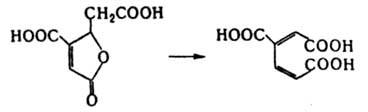
Внутримол. трансферазы катализируют перемещение групп из одного положения молекулы в другое. Относительно хорошо изученный фермент этой группы фосфоглицерат-фосфомутаза, к-рая катализирует превращ. D-глицерин-2-фосфата в D-глицерин-3-фосфат. Механизм р-ции включает гидролитич. расщепление фосфоэфирной связи в положении 2 с образованием фосфорилированного фермента и фосфорилирование глицерина в положение 3 ("пинг-понг"-механизм). Ряд ферментов этой группы катализирует перемещение аминогрупп. Мн. из них в качестве кофактора используют коферментные формы витамина В12. Характерный фермент этой подгруппы - лизин - 2,3-аминомутаза, катализирующая превращение L-лизина в L-3,6-диаминогексановую к-ту. К этой же группе относятся ферменты, катализирующие перемещение ацильной и др. групп. Внутримол. лиазы катализируют р-ции, в к-рых группа, отделяемая от одной части молекулы, остается в результате превращений ковалентно связанной с др. частью этой же молекулы. Напр., 3-карбокси-циc, цис-муконат-циклоизомераза катализирует превращ. 4-карбоксимуконолактона в 3-карбокси-цис, циc-муконовую к-ту:
Все изомеразы играют важную роль в обмене в-в.
Литература
Фершт Э., Структура и механизм действия ферментов, пер. с англ., М.. 1980; Диксон М., Уэбб Э., Ферменты, пер. с англ.. т. 1-2, М., 1982.
Ещё по теме
Топоизомеразы и их роль в биологии ДНК
Изомеразы — класс ферментов и их роль в биохимии
Изоферменты — строение и роль в диагностике
Полидезоксирибонуклеотид-синтетазы и их роль в синтезе ДНК
Изомерия в химии — виды и значение
Классификация и номенклатура ферментов
Ферменты — катализаторы жизни
Механизмы дезаминирования аминокислот
Декарбоксилирование аминокислот — механизмы и роль в организме
Аллостерическая регуляция ферментов — механизмы и примеры
РНК-полимеразы — строение и функции
Изомерия в химии — виды, примеры и роль в науке и жизни
Нуклеазы — функции и применение ферментов
