Пептидогликаны
ПЕПТИДОГЛИКАНЫ (муреины, мукопептиды), смешанные углевод-белковые полимеры, компоненты клеточной стенки бактерий. Углеводные цепи пептидогликанов построены из регулярно чередующихся остатков N-ацетил-D-глюкозамина и его 3-О-(R)-1-кар-боксиэтилового эфира (мурамовой к-ты), соединенных b-l  4-связями. Мурамовая к-та связана пептидной связью с тетра- или пентапептидами, к-рые образуют поперечные сшивки между отдельными углеводными цепями (см. схему). Гигантские сетчатые молекулы пептидогликаны образуют жесткий чехол вокруг бактериальной клетки, к-рый поддерживает ее форму и защищает клетку от разрушения при мех. и осмо-тич. воздействиях. К пептидогликанам ковалентными связями присоединяются др. компоненты клеточной стенки - тейхоевые кислоты и тейхуроновые к-ты, липопротеины.
4-связями. Мурамовая к-та связана пептидной связью с тетра- или пентапептидами, к-рые образуют поперечные сшивки между отдельными углеводными цепями (см. схему). Гигантские сетчатые молекулы пептидогликаны образуют жесткий чехол вокруг бактериальной клетки, к-рый поддерживает ее форму и защищает клетку от разрушения при мех. и осмо-тич. воздействиях. К пептидогликанам ковалентными связями присоединяются др. компоненты клеточной стенки - тейхоевые кислоты и тейхуроновые к-ты, липопротеины.
Углеводные цепи пептидогликанов, выделенных из разл. бактерий, отличаются незначительно. Так, аминогруппы остатков мурамовой к-ты в нек-рых пептидогликанах могут быть свободны, ацилирова-ны гликолевой к-той или образуют амидную связь с соседней карбоксильной группой; изредка встречается аналог мурамовой к-ты, имеющий D-манно-конфигурацию. Аминогруппы остатков глюкозамина также иногда свободны; отдельные гидроксильные группы полимера м. б. ацетилирова-ны или фосфорилированы. Напротив, пептидные фрагменты пептидогликанов характеризуются очень сильной изменчивостью: известно ок. 100 разл. структур пептидных участков, общими чертами к-рых является обязательное наличие остатков аминокислот D-ряда и присутствие редких диаминокислот (L-гидроксилизина, L-орнитина, мезо-диаминопимелиновой к-ты и др.). В большинстве пептидогликанов, как показано на схеме, поперечные сшивки построены по типу А (с дополнит. пептидным мостиком I в грамположит. бактериях), реже встречаются сшивки типа В.
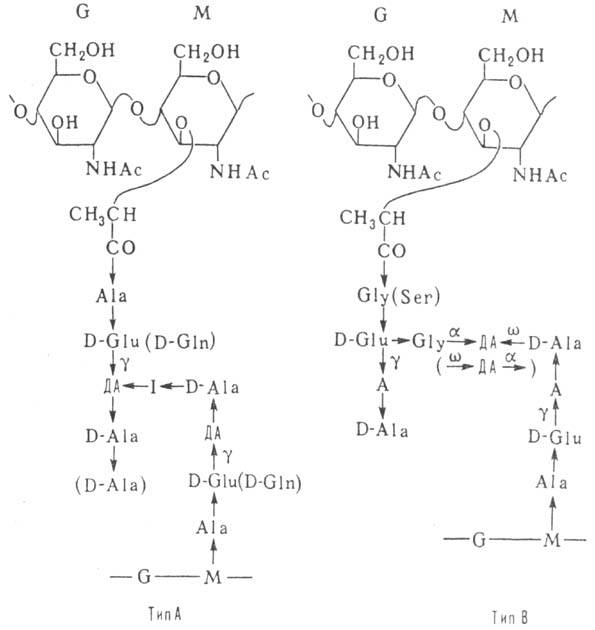
A L-аминокислота, ДА диаминокислота, I межпеш-идный мостик (состоит из неск. остатков аминокислот, но может отсутствовать), а а-аминогруппа диами-нокислоты, g-g-карбоксил отстатка D-глутаминовой к-ты. w дистальная (отдаленная) аминогруппа остатка диаминокнслоты, направление пептидной связи СО NH, G остаток N-ацетил-О-глюкозамина. M остаток N-ацетил-D-мурамовой к-ты.
направление пептидной связи СО NH, G остаток N-ацетил-О-глюкозамина. M остаток N-ацетил-D-мурамовой к-ты.
Биосинтез пептидогликанов начинается с образования УДФ-N-ацетил-D-мурамовой к-ты (УДФ-уридиндифосфат) из УДФ-N-ацетил-D-глюкозамина и фосфоенолпирувата, после чего происходит последоват. присоединение аминокислотных остатков к карбоксильной группе остатка молочной к-ты (напр., L-Ala, D-Glu, L-Lys и D-Ala—D-Ala во мн. грамположит. бактериях с образованием нуклеотид-мурамил-пентапептида; букв. обозначения см. в ст. Аминокислоты). Затем остаток мурамилпептидфосфата переносится на ундекапренилфосфат; дальнейшие стадии: присоединение остатка N-ацетил-D-глюкозамина b-l 4-связью к остатку мурамовой к-ты, наращивание пептидной цепи по w-аминогруппе диаминокислоты (напр., присоединение пяти остатков глицина в грамположит. бактериях с образованием будущего межпептидного мостика I; см. схему) и присоединение дисахаридпептидного повторяющегося звена к растущей линейной углеводной цепи - происходят на мембране под действием мембранных ферментов. Заключит. стадия-образование поперечных сшивок-происходит на наружной стороне мембраны путем транспептидазной р-ции (с потерей концевого D-Ala пентапептидного фрагмента).
4-связью к остатку мурамовой к-ты, наращивание пептидной цепи по w-аминогруппе диаминокислоты (напр., присоединение пяти остатков глицина в грамположит. бактериях с образованием будущего межпептидного мостика I; см. схему) и присоединение дисахаридпептидного повторяющегося звена к растущей линейной углеводной цепи - происходят на мембране под действием мембранных ферментов. Заключит. стадия-образование поперечных сшивок-происходит на наружной стороне мембраны путем транспептидазной р-ции (с потерей концевого D-Ala пентапептидного фрагмента).
Антибиотики, нашедшие широкое применение в медицине (пенициллины, цефалоспорины, циклосерин и нек-рые др.), блокируют отдельные стадии биосинтеза пептидогликанов; отсутствием пептидогликанов в клетках эукариот (все организмы, за исключением бактерий и синезеленых водорослей) объясняется избирательность этих антибиотиков по отношению к бактериальным клеткам. Бактерицидное действие фермента лизоцима обусловлено расщеплением углеводных цепей пептидогликанов путем гидролиза гликозидных связей остатков N-ацетил-D-мурамовой к-ты.
Наиб. богаты пептидогликанамиклеточные стенки грамположит бактерий (до 50% по массе), стенки грамотрицат. бактерий содержат менее 10% пептидогликанов, а в микоплазмах (клетки, лишенные клеточной стенки) и архебактериях (группа бактерий, отличающаяся от истинных бактерий, или эубактерий, по ряду физиол. и биохим. св-в) пептидогликаны отсутствуют. Сведения о строении пептидогликанов, получаемые с помощью методов структурного анализа углеводов и пептидов, представляют большую ценность для таксономии, в первую очередь при идентификации грамположит. бактерий, где разнообразие структур пептидогликанов особенно велико.
Пептидогликаны и фрагменты их молекул обладают разнообразным биол. действием на клетки и на организм животных и человека. В частности, пептидогликаны являются носителями неск. антигенных детерминант, способны стимулировать неспецифич. устойчивость к бактериальным инфекциям, обладают адъювантной активностью (повышают иммуногенность антигена), могут вызывать воспаление, поражение внутр. органов, увеличивать проницаемость капилляров, проявлять пи-рогенный эффект (повышение т-ры тела).
Лит Франклин T . Сноу Дж , Биохимия антимикробного действия, пер с англ M . 1984. Schleifer K. H.. "Methods Microbiol.". 1985, v 18, p. 123 56.
А И Усов
