Пептидная связь
Главными структурными единицами белкой и пептидов являются остатки аминокислот, связанные карбоксамидной пептидной связью между α-карбоксильной и α-аминогруппой.
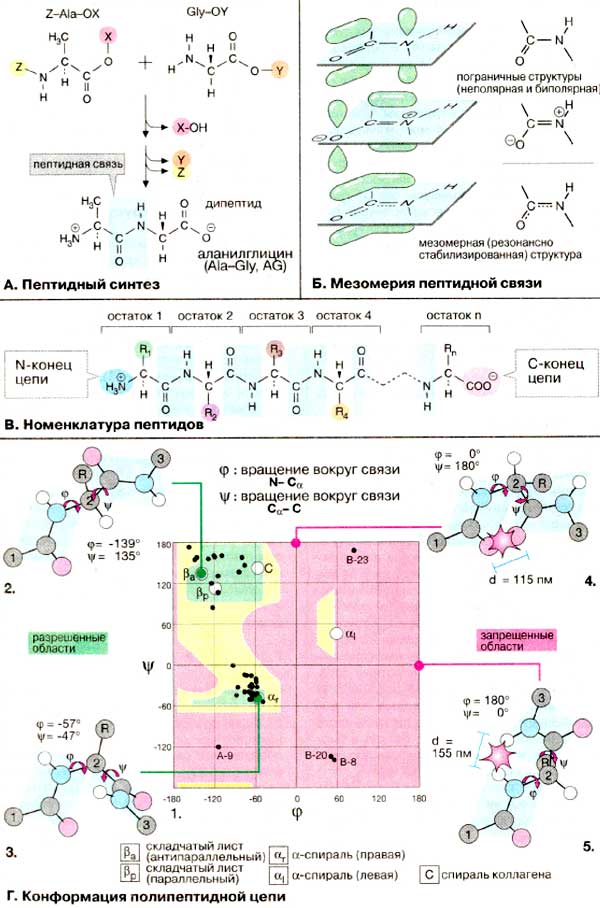
A. Пептидный синтез
В клетках пептиды и белки синтезируются в процессе трансляции на рибосомах. При химическом синтезе пептидов следует помнить, что целевой продукт образуется с высоким выходом лишь при условии, что функциональные группы, не участвующие в реакции, заблокированы защитными группировками (X,Y). В противном случае в приведенном примере наряду с целевым дипептидом AIa-Gly должны образовываться Gly-Ala, Gly-Gly и Ala-Ala. Кроме того, необходимо активировать карбоксильную группу (Z), что облегчает нуклеофильное присоединение по аминогруппе. В настоящее время пептиды с определенной аминокислотной последовательностью получают с помощью автоматических пептидных синтезаторов.
Как всякая карбоксамидная связь, пептидная связь стабилизирована за счет мезомерии (резонансно стабилизирована) (см. с. 12) и поэтому является практически плоской (планарной). Вращение вокруг связи C-N требует больших затрат энергии и, следовательно, затруднено. На схеме плоскость, в которой расположены 6 атомов пептидной группы, окрашена в светло-голубой цвет.
B. Номенклатура пептидов
Пептидная цепь имеет одно направление и два разных конца — N-конец, несущий свободную аминогруппу первой аминокислоты, и С-конец, несущий карбоксильную группу последней аминокислоты. Напомним, что в белках и пептидах аминокислотные остатки связаны в цепочку последовательно. Для того чтобы назвать конкретный пептид, достаточно перечислить (начиная с N-конца) последовательность входящих в его состав аминокислотных остатков в трехбуквенном или однобуквенном коде. Например, аминокислотная последовательность пептидного гормона ангиотензина Il читается следующим образом: Asp-Аrg-Vаl-Туr-Ile-His-Pro-Phe или соответственно DRVYIHPF.
Г. Конформация полипептидной цепи
Каждый аминокислотный остаток, за исключением концевых, принимает участие в образовании двух пептидных связей (с предыдущим и последующим фрагментами). Поскольку вращение вокруг связи C—N затруднено, повороты возможны только вокруг связей N--Cα и Cα--C (2). Такие повороты измеряются двугранными углами φ и ψ. Угол φ характеризует поворот вокруг связи N---Cα, а следовательно, положение предшествующей пептидной связи; угол ψ характеризует поворот вокруг связи Сα—С, т. е. положение последующей связи.
Для каждого конкретного аминокислотного остатка ввиду стерических ограничений разрешены только определенные комбинации углов вращения φ и ψ. Для наглядности информацию о связи между углами φ и ψ в каждом пептидном звене представляют графически с помощью φ/ψ-карты (1). На карте видно, что большинство комбинаций двугранных углов оказываются запрещенными (поля, выделенные красным цветом). Так, например, при комбинации φ = 0о / ψ = 180о (4) атомы кислорода карбонильных групп должны сблизиться на расстояние 115 пм, что намного меньше, чем сумма вандерваальсовых радиусов двух атомов. Аналогичным образом, при комбинации φ = 180о / ψ = 0о (5) происходит наложение водородных атомов двух ΝΗ-групп. Поэтому для углов φ и ψ остаются разрешенными сочетания, лежащие в пределах дискретных областей, окрашенных в зеленый цвет (2, 3). В эти разрешенные области попадают все приведенные на последующей схеме вторичные структуры. Конформации, попадающие в зоны, выделенные желтым цветом, энергетически невыгодны, но возможны.
Конформационные карты (карты Рамачандрана) построены на основе модельных экспериментов с небольшими пептидами. Однако конформационные параметры большинства аминокислотных остатков в белках также попадают в разрешенные области карты. На карте 1 черными точками показаны пары углов φ и ψ в небольшом белке инсулине.


