Способы получения
Формально можно было бы представить образование простейшего пептида как взаимодействие двух аминокислот с отщеплением молекулы воды, например:
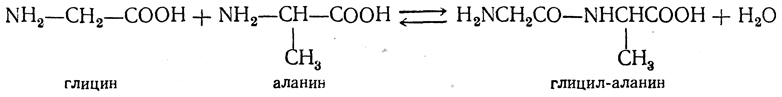
Однако пептидная связь, как всякая амидная, сравнительно легко гидролизуется, т. е. приведенная выше реакция обратима. Более того, в обычных условиях равновесие сильно смещено влево, в сторону гидролиза пептидной связи. Поэтому для синтеза пептидов применяются не сами аминокислоты, а их более реакционноспособные производные. Такой прием часто называют активированием аминокислоты.
Синтез пептида с заданной последовательностью аминокислот возможен лишь при условии, что те аминные и карбоксильные группы, которые не должны участвовать в реакции, будут заранее «защищены». Невыполнение этого условия привело бы даже в простейшем случае к образованию сложной смеси пептидов. Так, в рассмотренном примере равновероятны образование глицил-аланина и изомерного ему аланил-глицина:
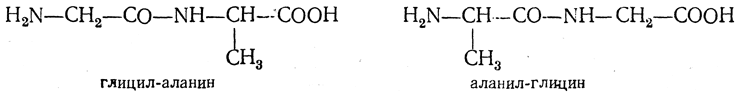
Разумеется, защитные группировки должны легко удаляться, когда в них отпадает надобность.
Синтез пептидов не только дает возможность получать новые представители этого класса соединений, но, что особенно важно, открывает путь к синтезу сложных природных веществ — антибиотиков и белков. Поэтому необходимо синтезировать оптически деятельные пептиды, используя оптически деятельные исходные соединения и методы, по возможности исключающие рацемизацию.
В настоящее время разработано много методов синтеза пептидов, различающихся по способам активирования и защиты реакционноспособных групп аминокислот.


