Фторпроизводные углеводородов
Свойства соединений этого класса резко различаются в зависимости от того, сколько атомов фтора находится при одном углеродном атоме. Так, монофторалканы устойчивы лишь от фтористого метила до фтористого н-бутила. Высшие н-алкил-фториды легко отщепляют фтористый водород с образованием олефинов. Вторичные и третичные монофторалканы еще менее устойчивы. Все монофторалканы токсичны. Введение двух атомов фтора к одному углеродному атому резко повышает устойчивость и понижает токсичность соединения. Поэтому, например, такие вещества, как СН3—CHF2 (т. кип. —24,7° С) и СН3—CF2—СН3 (т. кип. —0,3° С), являются весьма прочными соединениями.
Полностью фторированные соединения — фторуглероды, пер-фторуглероды, или перфторпарафины, — чрезвычайно устойчивы, негорючи и нетоксичны. Они не подвергаются расщеплению при нагревании даже до 400—500° С; при более высоких температурах они разлагаются на CF4 и элементарный углерод.
Вообще в органической химии фтор как заместитель водорода занимает совершенно особое место. Способность его давать прочные фторуглероды (по крайней мере, с прямой цепью) простирается, по-видимому, почти неограниченно. Фторуглероды дают ряды производных, аналогичные рядам производных углеводородов. Поэтому можно считать, что фторуглероды являются такой же основой химии фторорганических соединений, как углеводороды являются основой химии обычных органических соединений.
Для фторуглеродов ввиду их принципиальной важности разработана и в настоящее время широко применяется новая номенклатура, построенная по типу женевской номенклатуры алканов. В этом случае типовое окончание алканов ан заменяется окончаниехм форан. Таким образом, тетрафторуглерод получает название метфоран, соединение C2F6 будет называться этфораном, C3F8 — пропфораном и т. д. Соответственно, радикалы получают названия, аналогичные названиям алкилов:
CF8—метфорил, CF3CF2CF2CF2— н-бутфорил,
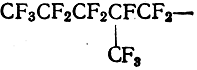
2-метфоропентфорил и т. п.
Названия соединений, одновременно содержащих атомы фтора и водорода, можно производить как от названий соответствующих форанов, так и от алканов, руководствуясь в каждом случае целесообразностью — краткостью и наглядностью, например CF3CH2CF2CF3 — 2,2-дигидробутфоран и CH3CF2CH2CH3 — 2,2-дифторбутан.
Для получения фторуглеродов существует несколько способов, которые дают обычно смеси перфторуглеродов с частично фторированными углеводородами. Важнейшим из этих способов является попеременное пропускание фтора (при 350° С) и углеводорода (при 200—300° С) над двуфтористым кобальтом. На первой стадии процесса CoF2, присоединяя фтор, превращается в CoF3, а последний способен фторировать углеводороды:
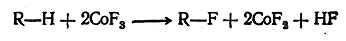
Таким образом постепенно происходит замещение всех атомов водорода. Чередование этих стадий делает процесс по существу непрерывным.
Аналогично фторидам кобальта ведут себя некоторые другие соли, в первую очередь AgF2, CeF4 и MnF3.
По другому способу углеводород, сильно разбавленный азотом, пропускают вместе с фтором через реактор, заполненный медными стружками или сеткой. Без этих предосторожностей фтор реагирует с углеводородами настолько энергично и с выделением такого большого количества тепла, что это может привести к взрыву. Медь, благодаря ее высокой теплопроводности, быстро отводит выделяющееся тепло, препятствуя взрыву. Еще лучшие результаты получаются, если медные стружки посеребрить или позолотить. Тогда теплоотвод сочетается с каталитическим действием высших фторидов металлов, например AgF2.
Прямое фторирование можно производить и в жидкой фазе, растворив фторируемое вещество в четыреххлористом углероде. В присутствии солей ртути в качестве катализатора можно непосредственно фторировать даже уголь, получая смесь фторуглеродов, содержащую главным образом метфоран и его ближайшие гомологи и в меньшем количестве высшие гомологи вплоть до C22F46.
Важным способом получения фторуглеродов является электрохимическое фторирование — электролиз органических соединений, растворенных в плавиковой кислоте. При этом в одну стадию получаются фторуглероды или их производные, например:
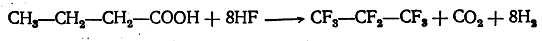
Одновременно в некотором количестве получаются неполностью фторированные углеводороды и фторангидрид фторированной кислоты CF3—CF2—CF2—COF.
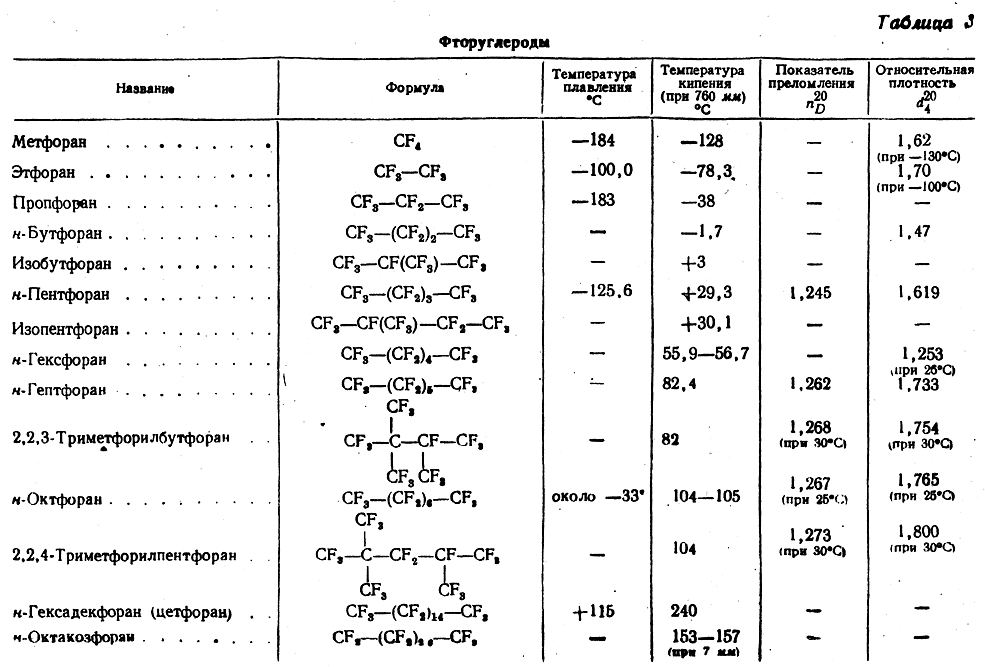
Физические свойства фторуглеродов (табл. 3) имеют ряд особенностей. Температуры кипения фторуглеродов ниже, чем у предельных углеводородов с тем же числом атомов углерода и тем же строением, несмотря на более высокий молекулярный вес. Например, н-гептан (мол. вес 100) кипит около 98° С, тогда как н-гептфоран (мол. вес 388) кипит при 82° С. Гомологическая разность температур кипения для средних членов гомологических рядов составляет у парафинов 26—27° С, а у перфторпа-рафинов — около 22° С.
Плотности фторпарафинов значительно выше, чем для углеводородов (например, для н-гептана d420=0,684, а для н-гепт-форана d420 = 1,733), что соответствует большей массе атома фтора.
Так как атомная рефракция фтора очень мала (в отличие от других элементов она не постоянна, а колеблется от 0,99 до 1,23 для D линии натрия), показатели преломления перфторпа-рафинов до C15 ниже, чем у воды.
Насыщенные фторуглероды характеризуются очень большой химической стойкостью. Особенно важна их устойчивость против окисления, в том числе против медленного окисления кислородом воздуха. Кроме того, в природе нет микроорганизмов, приспособившихся к питанию фторуглеродами. Все это делает фторуглероды надежными, исключительно долговечными техническими материалами.
Очень большой интерес представляют также вещества, содержащие в молекуле одновременно хлор и фтор. Они известны в технике под названием фреонов (Мидглей, Хенне) и находят применение в качестве хладоагентов — рабочих тел в холодильных машинах (вместо жидкого аммиака или сернистого ангидрида).
Важнейшим из них является дифтордихлорметан CF2Cl2. В обычных условиях это бесцветный, без запаха и вкуса газ, сгущающийся в жидкость, кипящую при —30° С и замерзающую при —155° С. Он получается действием на четыреххлористый углерод трехфтористой сурьмы в присутствии фтористого водорода.
При этом SbF3 сначала реагирует с четыреххлористым углеродом:
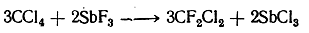
а затем регенерируется под действием фтористого водорода:
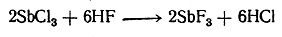
Замечательной является инертность как хлора, так и фтора в этом веществе, благодаря чему пары его совершенно нетоксичны. Более подробное изучение таких производных показало, что присутствие в молекуле по меньшей мере двух атомов фтора при одном из атомов углерода стабилизирует вещество и даже делает инертными атомы другого галоида (хлора, брома).


