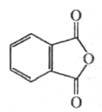
Фталевый ангидрид
ФТАЛЕВЫЙ АНГИДРИД (ангидрид 1,2-бензолдикарбоно-вой к-ты), мол. м. 148,12; бесцв. орторомбич. кристаллы (параметры решетки а =0,790 HM, b =1,416 HM, с = 0,594 HM); легко возгоняется, т. пл. 130,850C, т. кип. 294,5 0C; 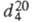 1,527;
1,527;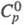 кДж(кг-К): 1,00 (О 0C), 1,07 (20 0C), 1,70 (150 0C); h (Па-с) 1,19 (133 0C), 0,55 (220 0C); g 0,035 Н/м (155 0C), 0,0327 Н/м (180 0C); давление пара в мм рт.ст.: 0,0018 (35 0C), 0,11 (5O0C), 0,712 (100 0C), 5,88 (130 0C); DH0обр -460,02 кДж/моль,
кДж(кг-К): 1,00 (О 0C), 1,07 (20 0C), 1,70 (150 0C); h (Па-с) 1,19 (133 0C), 0,55 (220 0C); g 0,035 Н/м (155 0C), 0,0327 Н/м (180 0C); давление пара в мм рт.ст.: 0,0018 (35 0C), 0,11 (5O0C), 0,712 (100 0C), 5,88 (130 0C); DH0обр -460,02 кДж/моль,  22,93 кДж/моль, DH0сгор -3259 кДж/моль;
22,93 кДж/моль, DH0сгор -3259 кДж/моль; 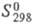 1,79 кДж(моль·°С). Р-римость (в г на 100 г р-рителя): в HCOOH 4,7 (20 0C), CCl4 0,7 (20 0C), CS2 0,7 (20 0С), пиридине 80 (25 0C), воде 0,62 (25 0C), 19,0 (100 0C), 95,0 (135 0C; с образованием фталевой к-ты); плохо раств. в этаноле и диэтиловом эфире.
1,79 кДж(моль·°С). Р-римость (в г на 100 г р-рителя): в HCOOH 4,7 (20 0C), CCl4 0,7 (20 0C), CS2 0,7 (20 0С), пиридине 80 (25 0C), воде 0,62 (25 0C), 19,0 (100 0C), 95,0 (135 0C; с образованием фталевой к-ты); плохо раств. в этаноле и диэтиловом эфире.
Обладает св-вами ароматических соединений. При нагр. с моноатомными спиртами в присут. H2SO4 (130-140 0C) или орг. солей Ti (200 0C) образует соответствующие сложные моно- и диэфиры, с многоатомными спиртами в присут. высоких к-т - полиэфиры (см. Алкидные смолы). Напр., на основе фталевого ангидрида и диолов (этилен-, диэтиленгликоля, пропилен-гликоля) получают полиэфиры; на основе фталевого ангидрида и глицерина -алкидные (глифталевые) смолы.
Хлорирование фталевого ангидрида приводит к ангидриду тетрахлорфтале-вой к-ты, из к-рого получают самозатухающие полиэфирные смолы. С PCl5 образует фталоилдихлорид C6H4(COCl)2. При нитровании фталевый ангидрид дает смесь 3- и 4-нитрофталевых к-т, при сульфировании - смесь 3- и 4-сульфопроизводных. С NH3 и первичными аминами в зависимости от условий р-ции фталевый ангидрид образует фталаминовую к-ту (ф-ла I), фталимид (II) или диамид фталевой к-ты (ПI):
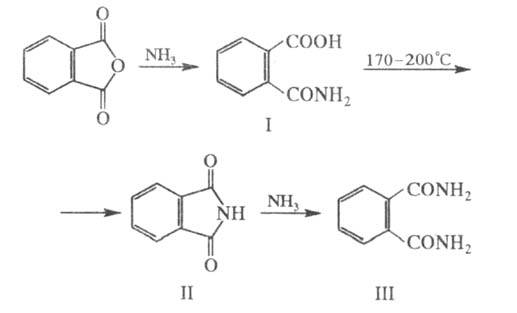
При пропускании паров фталевого ангидрида и NH3 при 350-400 0C над оксидами Al, V, W, Cr или Mn получается фталодинитрил.
Конденсация фталевого ангидрида с бензолом в присут. AlCl3 и H2SO4 приводит к антрахинону:
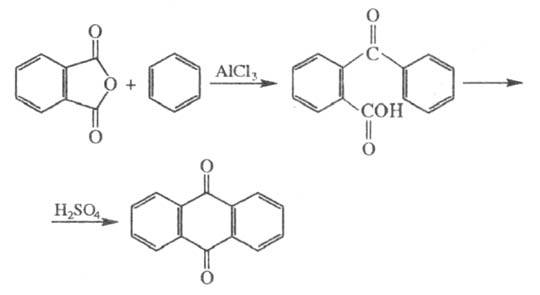
Фталевый ангидрид легко реагирует с фенолами и их производными. Так, р-ция с фенолом в присут. H2SO4 и SnCl2 приводит к фенолфталеину, с м-(этиламино)фенолом - к родамину, с резорцином - к флуоресцеину (см. Ксантеновые красители), с n-хлорфенолом - к хинизарину. С мочевиной и солями Cu фталевый ангидрид образует нерастворимые пигменты фталоцианины, применяемые в качестве красителей. Декарбоксилирование фталевого ангидрида при 200 0C в присут. Al2O3, ZnO приводит к бензойной к-те; это один из пром. способов ее получения.
Каталитич. гидрирование фталевого ангидрида на никелевом катализаторе при 150 0C приводит последовательно к фталиду, о-толуило-вой к-те, гексагидро-о-толуиловой к-те; гидрирование при 5 МПа и 300 0C над тем же катализатором - к гексагидро-фталевой к-те:
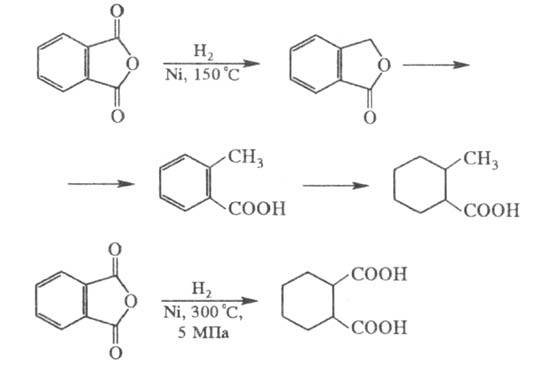
Фталевый ангидрид при взаимод. с KOH превращается в дикалиевую соль фталевой к-ты, к-рая при 350-400 0C в присут. CaCO3 и Zn изомеризуется в терефталевую к-ту.
В пром-сти фталевый ангидрид получают парофазным каталитич. окислением кислородом воздуха о-ксилола или нафталина с использованием стационарных или псевдоожиженных (нафталин) катализаторов на основе V2O5 - TiO2 или V2O5 - K2SO4. Процесс проводят при 350-400 0C с избытком O2 воздуха (концентрация углеводорода 40-80 г/м3). Сырой фталевый ангидрид из реакционных газов улавливают в твердом виде в аппаратах калориферного типа, очищают и выделяют ректификацией. Выход при окислении о-ксилола 75-80%, нафталина 85-88%.
Фталевый ангидрид применяют в произ-ве красителей, алкидных смол, пластификаторов, инсектицидов, лек. ср-в, тетрахлорфтале-вого ангидрида. Фталевый ангидрид- реагент для обнаружения и титримет-рич. определения низших первичных и вторичных алифатич. спиртов, идентификации фенолов и фенольных смол.
Фталевый ангидрид токсичен, вызывает раздражение кожи, слизистых оболочек глаз и носа, способствует заболеванию бронхиальной астмой. ЛД50 4 г/кг (мыши, перорально); ПДК 1 мг/м3, ПДК (в воде) 0,5 мг/л. T. всп. 152 0C, т. воспл. 165 0C, т.са-мовоспл. 580-584 0C; КПВ 10,5% по объему. Объем мирового произ-ва ок. 2,5 млн. т в год (1988).
Лит.: Гуревич Д.А., Фталевый анщдрид, M., 1968; Kirk-Othmer encyclopedia, 3 ed., v. 17, N.Y., 1982, p. 732-46. А.G. Любарский.
