Аммония нитрат
АММОНИЯ НИТРАТ (аммиачная селитра) NH4NO3, бесцв. гигроскопичные кристаллы; т. пл. 169,6°С, т. кип. 235 °С. Сведения о кристаллич. модификациях приведены в таблице.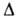 Н° полиморфных переходов IV
Н° полиморфных переходов IV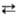 Ш 1,7 кДж/моль, III
Ш 1,7 кДж/моль, III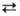 П 1,3 кДж/моль. При переходах II -> III, IV -> III и IV -> V объем элементарной ячейки увеличивается.
П 1,3 кДж/моль. При переходах II -> III, IV -> III и IV -> V объем элементарной ячейки увеличивается.
СВОЙСТВА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ NH4NO3
| Модификация | Кристаллич. решетка | Область существования, | Параметры решетки, нм | ||
| а | b | с | |||
| I | Кубич. | 125,8-169,6 | 0,441 | ||
| II | Тетрагон. | 84,2-125,8 | 0,576 | _ | 0,502 |
| III | Ромбич. | 32,2-84,2 | 0,718 | 0,771 | 0,583 |
| IV | Ромбич. | от 32,2 до -16,9 | 0,494 | 0,544 | 0,575 |
| V | Тетрагон. | Ниже -16,9 | 0,572 | — | 1,600 |
Для модификации IV: плотн. 1,725 г/см3; Сp° 139,4 ДжДмоль*К); Н°пл5,86 к Дж/моль,
Н°пл5,86 к Дж/моль,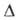 Нообр -365,7 кДж/моль,
Нообр -365,7 кДж/моль,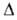 СобР -184 кДж/моль; S°298 151,1 Дж/(моль*К). Для жидкого аммония нитрата плотн. 1,436 г/см3 (170°С), 1,414 г/см3 (220°С);
СобР -184 кДж/моль; S°298 151,1 Дж/(моль*К). Для жидкого аммония нитрата плотн. 1,436 г/см3 (170°С), 1,414 г/см3 (220°С);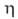 5,71 мПа*с (170°С), 3,23 мПа*с (220°С);
5,71 мПа*с (170°С), 3,23 мПа*с (220°С);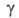 98,8 мН/м2 (179°С), 98,4 мН/м2 (187°С);
98,8 мН/м2 (179°С), 98,4 мН/м2 (187°С);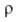 2,5 Ом*см (175°С). Ур-ния температурной зависимости давления пара: Ig p (мм рт. ст.) = 10,708 - 4670/Т (349-438 К), I gp (мм рт. ст.) = 9,981 - 4360/Т (373-513 К). Р-римость аммония нитрата (г в 100 г р-рителя): в воде -119 (0°С), 212 (25°С), 346 (50°С); жидком NH3-391 (25 °С). Раств. также в метаноле, этаноле, пиридине. При 200-270°С разлагается: NH4NO3 -> N2O+ 2Н2О + 36,8 кДж/моль. Выше 270°С или при воздействии удара может разлагаться со взрывом:
2,5 Ом*см (175°С). Ур-ния температурной зависимости давления пара: Ig p (мм рт. ст.) = 10,708 - 4670/Т (349-438 К), I gp (мм рт. ст.) = 9,981 - 4360/Т (373-513 К). Р-римость аммония нитрата (г в 100 г р-рителя): в воде -119 (0°С), 212 (25°С), 346 (50°С); жидком NH3-391 (25 °С). Раств. также в метаноле, этаноле, пиридине. При 200-270°С разлагается: NH4NO3 -> N2O+ 2Н2О + 36,8 кДж/моль. Выше 270°С или при воздействии удара может разлагаться со взрывом:
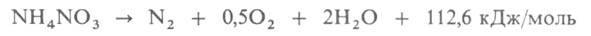
Аммония нитрат обычно получают нейтрализацией 60%-ной HNO3 газообразным NH3 с использованием теплоты р-ции (145 кДж/моль) для упаривания р-ра NH4NO3. Образующийся аммония нитрат гранулируют. Для получения прочных гранул, обеспечивающих возможность бестарных перевозок, и повышения срока хранения в аммония нитрат вводят (NH4)2SO4, Mg(NO3)2 или смесь (NH4)2SO4 с NH4H2PO4 (обычно не более 0,5% по массе). Мощность агрегатов по произ-ву аммония нитрата до 450-520 тыс.т/год.
Аммония нитрат - азотное удобрение. Его применяют также в произ-ве ВВ (напр., аммонитов, гранулитов), как реагент для растворения циркониевых оболочек твэлов при регенерации облученного ядерного топлива. Мировое произ-во 14 млн. т/год в пересчете на азот (1980). Аммония нитрат впервые был получен И.Р. Глаубером в 1659.
Литература
Технология аммиачной селитры, под ред. В. М. Олевского, М., 1978; Олевский В. М., Ферд М. Л., "Ж. Всес. хим. о-ва им. Д.И.Менделеева", 1983, т. 28, № 4, с. 27-39. В.М. Олевский.
