Рутений
РУТЕНИЙ (от ср.-век. лат. Ruthenia-Россия; ruthenium) Ru, хим. элемент VIII гр. периодич. системы, ат. н. 44, ат. м. 101,07; относится к платиновым металлам. В природе встречается семь стабильных изотопов: 96Ru (5,7%), 98Ru (2,2%), 99Ru (12,8%), 100Ru (12,7%), 101Ru (17,0%), 102Ru (31,3%), 104Ru (18,3%). Конфигурация внеш. электронных оболочек атома 4d75s1. Наиб. характерные степени окисления +3, +4, +6, +8; энергии ионизации Ru0 : Ru1+ : Ru2+ : Ru3+ соотв. 7,366, 16,763 и 28,46 эВ; атомный радиус 0,134нм, ионные радиусы (в скобках указаны координац. числа) Ru3+ 0,082 нм (6), Ru4+ 0,076 нм (6), Ru5+ 0,071 нм (6), Ru7+ 0,052 нм (4), Ru8+ 0,050 нм (4).
Рутений- редкий рассеянный элемент. Содержание в земной коре 5-10 % по массе. Собств. минералы-лаурит (RuS2), py-тенарсенид (RuAs)-очень редки. Вместе с др. платиновыми металлами рутений содержится в рутениевом невьянските (Ir, Os, Ru), рутениевом сысертските (Os, Ir, Ru), самородной платине, осрутине (Os, Ru), в виде изоморфной примеси-в пент-ландите, пирротине, кубаните, халькопирите (в медно-никелевых месторождениях).
Свойства. Рутений-блестящий серебристый металл. Кристал-лич. решетка гексагональная типа Mg, а = 0,27054 нм, с = 0,42825 нм, z = 2, пространств. группа P63/mmc; т.пл. 2334 °С, т. кип. 4077 °С; плотн. 12,45 г/см3;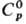 24,0 Дж/(моль·К);
24,0 Дж/(моль·К); 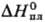 38,3 кДж/моль,
38,3 кДж/моль,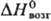 647,4 кДж/моль;
647,4 кДж/моль;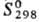 28,56 Дж/(моль · К); теплопроводность при 100 К монокристалла перпендикулярно оси с 140Вт/(м·К), параллельно оси с 180Вт/(м·К), для поли-кристаллич. 150 Вт/(м · К); температурный коэф. линейного расширения для монокристалла перпендикулярно оси с 5,8·10-6К-1 (300К), 7,95·10-6K-1 (1000 К). 13,02·10-6 К-1 (2000 К), параллельно оси с 8,7·10-6К-1 (300 К), 1,181·10-5K-1 (1000 К), 1,815·10-5 (2000 К); r при 273 К для монокристалла перпендикулярно оси с 3,16·10-7 Ом·м, параллельно оси с 2,17·10-7 Ом·м, для поликристаллич. 2,83·10-7 Ом·м; парамагнетик, уд. магн. восприимчивость при 100 К для монокристалла перпендикулярно оси с + 4,15·10-5, параллельно оси с + 3,20·10-5, для поликристаллич. 3,81·10-5; отражат. способность для электрополированного монокристалла 71,1% (l = = 0,265 мкм), 75,0% (0,302 мкм), 72,0% (0,404 мкм), 69,3% (0,500 мкм), 70,8% (0,600 мкм); коэф. Холла для поликристаллич. (99,8%-ной чистоты) +9,5·10-1 м3/Кл (100 К), + 7,0·10-11 м3/Кл (290 К), +4,5·10-1 м3/Кл (700 К), для монокристалла при 293 К перпендикулярно оси с + 1,75·10-10 м3/Кл, параллельно оси с +1,11·10-10 м3/Кл. Модуль Юнга 485,4 ГПа, sраст 172 ГПа, коэф. Пуассона 0,31; для отожженного образца техн. чистоты: модуль Юнга 430 ГПа, твердость по Бринеллю 2000-3000 МПа, условный предел текучести при растяжении 350-400 МПа (остаточная деформация 0,2%), 500-600 МПа (остаточная деформация 13%), относит. удлинение 3-10%, сужение 2-3%. Поликристаллический рутений с трудом поддается пластич. деформированию выше 1500°С. Рафинированный зонной плавкой монокристаллический рутений пластичен при комнатной т-ре.
28,56 Дж/(моль · К); теплопроводность при 100 К монокристалла перпендикулярно оси с 140Вт/(м·К), параллельно оси с 180Вт/(м·К), для поли-кристаллич. 150 Вт/(м · К); температурный коэф. линейного расширения для монокристалла перпендикулярно оси с 5,8·10-6К-1 (300К), 7,95·10-6K-1 (1000 К). 13,02·10-6 К-1 (2000 К), параллельно оси с 8,7·10-6К-1 (300 К), 1,181·10-5K-1 (1000 К), 1,815·10-5 (2000 К); r при 273 К для монокристалла перпендикулярно оси с 3,16·10-7 Ом·м, параллельно оси с 2,17·10-7 Ом·м, для поликристаллич. 2,83·10-7 Ом·м; парамагнетик, уд. магн. восприимчивость при 100 К для монокристалла перпендикулярно оси с + 4,15·10-5, параллельно оси с + 3,20·10-5, для поликристаллич. 3,81·10-5; отражат. способность для электрополированного монокристалла 71,1% (l = = 0,265 мкм), 75,0% (0,302 мкм), 72,0% (0,404 мкм), 69,3% (0,500 мкм), 70,8% (0,600 мкм); коэф. Холла для поликристаллич. (99,8%-ной чистоты) +9,5·10-1 м3/Кл (100 К), + 7,0·10-11 м3/Кл (290 К), +4,5·10-1 м3/Кл (700 К), для монокристалла при 293 К перпендикулярно оси с + 1,75·10-10 м3/Кл, параллельно оси с +1,11·10-10 м3/Кл. Модуль Юнга 485,4 ГПа, sраст 172 ГПа, коэф. Пуассона 0,31; для отожженного образца техн. чистоты: модуль Юнга 430 ГПа, твердость по Бринеллю 2000-3000 МПа, условный предел текучести при растяжении 350-400 МПа (остаточная деформация 0,2%), 500-600 МПа (остаточная деформация 13%), относит. удлинение 3-10%, сужение 2-3%. Поликристаллический рутений с трудом поддается пластич. деформированию выше 1500°С. Рафинированный зонной плавкой монокристаллический рутений пластичен при комнатной т-ре.
По хим. св-вам рутений-типичный представитель платиновых металлов. Стандартный электродный потенциал Ru2+ /Ru0 + 0,45 В. Рутений проявляет все степени окисления от 0 до +8. Простые соединения рутения обычно трудно получить в чистом виде. В р-рах существуют только комплексные ионы.
Компактный рутений не окисляется на воздухе до 930 °С; не раств. в р-рах щелочей, а также в H2SO4, HNO3, H3PO4, соляной, фтористоводородной и уксусной к-тах, царской водке. Порошкообразный рутений при нагр. окисляется О2 до RuO2. Мелкодисперсный рутений (чернь) взрывает на воздухе самопроизвольно. Губчатый рутений при нагр. медленно раств. в р-ре NaClO, в р-рах С12 в соляной к-те, Вr-2 -в бромистово-дородной к-те, I2- в этаноле; взаимод. с галогенами, S, Se, Те, поглощает Н2 с образованием твердых р-ров. С N2 металлический рутений не взаимод., но комплексные соединения рутения могут связывать азот воздуха, напр. [{Ru(NH3)5}2N2][BF4]4. Рутений сплавляется с большинством металлов. С переходными металлами образует твердые р-ры и промежут. фазы структурного типа CsCl и Cr3Si, а также s-фазы и фазы Лавеса (см. Интерметаллиды). Рутений переводят в р-р путем сплавления его со смесью KNO3 и КОН, пероксидами Ва или Na при 530 °С с послед. выщелачиванием плава, хлорированием смеси шихты рутения с КС1 при ~530 °С и дальнейшим выщелачиванием разб. соляной к-той.
Тетраоксид RuO4-золотисто-желтые кристаллы; т.пл. 25,5 °С, т. кип. 27 °С, т. разл. 108 °С; плотн. 3,29 г/см3 (21 °С); DH0обр -305,2 кДж/моль; р-римость в воде (г в 100 г): 2,033 (20 °С), 2,249 (74 °С); раств. в спиртах, ССl4; окислитель; взаимод. с разб. соляной к-той, давая хлорорутенаты. Получают взаимод. K2RuO4 с КОН и С12 либо K2RuO4 с КМnО4, или КIO4 и H2SO4; промежут. продукт при получении рутения при селективном выделении в аналит. химии; тетраоксид 105Ru извлекают из продуктов деления U и Рu.
Диоксид RuO2-темно-синие кристаллы тетрагон. син-гонии (а = 4,4919 нм, с = 0,31066 нм, пространств. группа Р42/тпт); т. разл. 730-750 °С; плотн. 6,97 г/см3; не раств. в воде, к-тах и щелочах при кипячении; при 400 °С восстанавливается Н2 до металла; взаимод. с оксидами (РbО, BaO, SrO, Bi2O3), давая рутенаты(IV), обладающие ме-таллич. типом проводимости, сам RuO2 также электро-проводен; при 298 К r для RuO2 4·10-3Ом·м, SrRuO3 4·10-2Ом·м, BaRuO3 6,5·10-2 Ом·м, Pb2Ru2O6 3,0·10-2 Ом·м, Bi2Ru2O7 4,7·10-1 Ом·м; получают прокаливанием выше 500 °С на воздухе Ru(OH)4, (NH4)2[RuCl6], (NH4)2[Ru(NO)Cl5]. RuO2 и рутенаты-резисторные материалы в микроэлектронике. Гидр оксид Ru(OH)4-черное аморфное в-во; получают восстановлением K2RuO4 этанолом, гидролитич. разложением солей Ru(IV); применяют в аналит. химии для концентрирования рутения из р-ров, осаждения рутения при его произ-ве.
Дисульфид RuS2-темно-зеленые кристаллы кубич. син-гонии (z = 4, пространств. группа Ра3, для минерала лаури-та а — 0,560 нм) или черное аморфное в-во; т. разл. 1000°С; плотн. 6,99 г/см3; 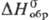 —197 кДж/моль; не взаимод. со щелочами и кипящей H2SO4; образуется при взаимод. H2S с р-рами солей Ru(IV); используется для выделения рутения из р-ров при его получении в аналит. химии.
—197 кДж/моль; не взаимод. со щелочами и кипящей H2SO4; образуется при взаимод. H2S с р-рами солей Ru(IV); используется для выделения рутения из р-ров при его получении в аналит. химии.
Пентафторид RuF5-темно-зеленые кристаллы; т.пл. 85,4 °С, т. кип. 227 °С; гигроскопичен; гидролизуется водой; получают взаимод. Ru с F2 при 300-450 °С.
Трихлорид RuCl3-черные или коричневые кристаллы, т.возг. 777 °С, т. разл. выше 500 °С; плотн. 3,11 г/см3;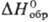 —205 кДж/моль; не раств. в воде, раств. в соляной к-те; получают взаимод. Ru с С12 в присут. СО при 330 °С; применяют при получении рутениевой черни и соед. Ru (карбонилов, рутеноцена и др.).
—205 кДж/моль; не раств. в воде, раств. в соляной к-те; получают взаимод. Ru с С12 в присут. СО при 330 °С; применяют при получении рутениевой черни и соед. Ru (карбонилов, рутеноцена и др.).
Рутенат(VI) калия K2RuO4-черно-зеленые кристаллы; т. разл. 440 °С; раств. в воде и р-рах щелочей, в к-тах диспропорционирует на Ru(IV) и Ru(VII); получают сплавлением рутения с КОН и KNO3 или К2О2; промежут. продукт при аффинаже рутения, используется также для приготовления катализаторов на носителях.
"Рутениевая красная соль" [Ru3O2(NH3)14]Cl6·4H2O-красные кристаллы; раств. в воде; получают длит. нагреванием р-ров соед. Ru(III) и NH3; применяют для гис-тологич. исследований животных и растит. тканей, как краску для фарфора. "Бурая соль" K4[Ru2OCl10]·H2O-бурые кристаллы; раств. в воде, не раств. в орг. р-рителях; получают взаимод. RuO4 с р-ром КС1 в соляной к-те или восстановлением K2RuO4 в соляной к-те спиртом; промежут. продукт при получении солей Ru(IV), Ru(OH)4, RuO2. Гексахлорорутенат(IV) аммония (NH4)2[RuCl6]-черные кристаллы; т. разл. 360 °С; плохо раств. в во'де, раств. в неорг. к-тах; получают взаимод. RuO4 с насыщ. р-ром NH4C1 в конц. соляной к-те; промежут. продукт при аффинаже рутения, при получении RuO2.
Аквапентахлорорутенат(III) калия K2[Ru(H2O)Cl5]-темно-красные кристаллы; т. разл. 180°С; раств. в воде и неорг. к-тах; получают кипячением K4[Ru2OCl10] в смеси соляной к-ты и этанола; применяют при получении рутения и соед. Ru(III).
Нитрозопентахлорорутенат(III) аммония (NH4)2[Ru(NO)Cl5]-малиново-красные кристаллы; т. разл. 320 °С; раств. в воде; получают взаимод. соед. Ru(III) или Ru(IV) с царской водкой и послед. удалением HNO3 и осаждением насыщ. водным р-ром NH4C1; промежут. продукт при получении RuO2 и нитрозокомплексов Ru(IV). Нитрозотринитрорутений(III) [Ru(NO)(NO3)3]·H2O-темно-вишневое твердое гигроскопичное в-во; раств. в воде, к-тах, р-рах щелочей, орг. р-рителях; получают взаимод. RuO4 с конц. HNO3 при нагр.; образуется при переработке облученного ядерного топлива. Гидроксонитрозотетра-нитрорутенат(III) натрия Na2[Ru(NO)(NO2)4(OH)]·2H2O-оранжевые кристаллы; ок. 100°С обезвоживается, ок. 200 °С разлагается; раств. в воде, ацетоне, этаноле; получают взаимод. соед. Ru(III) или Ru(IV) с насыщ. водным р-ром NaNO2; применяют для нанесения рутениевых покрытий на металлы, керамику.
Пентакарбонил Ru(CO)5-летучая жидкость; т.пл. — 22 °С; не раств. в воде, раств. в орг. р-рителях; получают взаимод. RuI3 с СО при 170°С (4,4 МПа) в присут. Ag; применяют для нанесения рутениевых покрытий из газовой фазы на металлы, стекло, керамику. Ацетилацетонат Ru(CH3COCH2COCH3 )3 - кроваво-красные кристаллы; т.пл. 76,4 °С; не раств. в воде, раств. в орг. р-рителях; получают взаимод. RuCl3 с ацетилацетоном и К2СО3; применяют для нанесения рутениевых покрытий из газовой фазы на металлы, стекло, кварц, керамику, для получения рутеноцена. См. также Рутенийорганические соединения.
Получение. Остатки после аффинажа шлиховой Pt или концентраты после переработки шламов электрорафинирования черновых Си и Ni сплавляют с ВаО2 или Na2O2, раств. в воде, на р-р действуют С12, отгоняют образовавшийся RuO4, к-рый поглощают из газов соляной к-той; затем осаждают (NH4)2 [RuCl6], прокаливают его до RuO2 и восстанавливают в токе Н2, получая рутениевый порошок 99,9%-ной чистоты. Выплавляют рутений и его сплавы в индукц. печах (в тиглях из стабилизированного ZrO2 или электро-плавленного магнезита) либо в дуговых печах в среде Аr или в вакууме.
Значит. кол-ва радиоактивного рутения предполагается извлекать из радиоактивных отходов, образующихся при работе АЭС.
Применение. Легирующие добавки рутения значительно повышают прочность, твердость, термич. и коррозионную стойкость сплавов. Рутений- компонент сплавов с Pt и Rh (для фильер, используемых в произ-ве стекловолокна и вискозы), с Ir, Os, W (для перьев авторучек), с Ir (для высокотемпературных термопар, эксплуатируемых до 2000 °С), с Pt и Pd (для изготовления износостойких деталей разл. измерит. приборов, электроконтактов, ювелирных изделий). Рутений и его сплавы с Pd, нанесенные в виде черней на носители,-катализаторы гидрирования и дегидрирования орг. соединений. Рутений используют также для нанесения защитных покрытий на электрич. контакты. Радиоактивные 103Ru (T1/2 39,8 сут) и 106Ru (T1/2 1 ч)-изотопные индикаторы.
Мировое произ-во рутения (без СНГ) не превышает 10 т/год.
Летучие и растворимые соединения рутения вызывают аллергию, раздражают слизистые оболочки, могут вызывать их изъязвление. ПДК в воздухе рабочей зоны для RuO2 1 мг/м3.
Рутений открыл К. К. Клаус в 1844.
Лит.: Синицын Н. М., в кн.: Благородные металлы я их заменители, Свердловск, 1971; Раевская М. В., Соколовская Е. М., Физикохимия рутения и его сплавов, М., 1979; Seddon E. А., Seddon K. R., The chemistry of ruthenium, Amst., 1984. H.M. Синицын.
