Железа оксиды
ЖЕЛЕЗА ОКСИДЫ. Оксид FeO (в технике - вюстит). В кристаллич. решетке вюстита имеются вакантные узлы, и его состав отвечает ф-ле FexO, где х = 0,89-0,95; ур-ние температурной зависимости давления разложения: lg p(O2, в мм рт. ст.) = - 26730/T+ 6,43 (T > 1813 К); см. также табл. В воде практически не раств., хорошо раств. в к-тах, р-рах щелочей. Легко окисляется; пирофорeн. После прокаливания хим. активность и пирофорность FeO снижаются. В природе - чрезвычайно редкий минерал иоцит. Получают восстановлением Fe2O3 водородом либо СО или при прокаливании в атмосфере N2 2FeC2O4.3H2O. Сесквиоксид Fe2O3 существует в трех полиморфных модификациях: наиб. устойчивая а (минерал гематит), g (маггемит, оксимагнетит) и d (с тригональной кристаллич. решеткой); т-ры перехода a : g 677°С, g : d 777°С; DH0 перехода a : g 0,67 кДж/моль. Для модификации a-Fe2O3 ур-ние температурной зависимости давления разложения: lg p(O2, в мм рт. ст.) = - 10291/T+ 5,751gT - 1,09.10-3Т -0,75.105Т-2 - 12,33; раств. в соляной и серной к-тах, слабо - в HNO3; парамагнетик, точка Нееля 953 К. Модификации g- и d-Fe2O3 ферримагнитны; g-Fе2О3образуется при низкотемпературном окислении Fe3O4 и Fe, d-Fe2O3 м. б. получен при гидролизе и окислении р-ров солей Fe(II). Оксид Fe(II,III) - соед. ф-лы Fe3O4, или FeO.Fe2O3, FeII(FeIIIO2)2 (минерал магнетит), при нагр. разлагается; при 627 °С a-форма переходит в b; ур-ние температурной зависимости давления разложения: lgp(O2, в мм рт. ст.) = = - 33265/Т+ 13,37 (Т > 843 К); ферримагнетик, точка Кюри 900 К; отличается высокой электрич. проводимостью. Раств. в к-тах с образованием солей Fe(II) и Fe(III), прокаленный при 1200-1300 °С прир. магнетит практически не раств. в к-тах и их смесях. При нагр. на воздухе окисляется до Fe2O3. Получают действием водяного пара на раскаленное железо, восстановлением Fe2O3, окислением FeO. Железа оксидам соответствует ряд гидроксидов. Гидроксид Fe(OH)2 образуется при действии щелочи на водные р-ры солей Fe(II); быстро окисляется до FeO(OH). Р-римость в воде 0,00015 г в 100 г (18°С), раств. в к-тах, р-рах щелочей с образованием гидроксоферратов(II), напр. Na2[Fe(OH)4], и р-рах NH4Cl. Гидроксиды Fe(III) образуют в природе ряд бурых железняков: гидрогематит Fe2O3.0,1H2O (твердый р-р воды в гематите), турьит 2Fe2O3.Н2О (тонкая мех. смесь гётита и гидрогематита), гётит a-FeO(OH), или Fe2O3.H2O, лепидокрокит g-FeO(OH), гидрогётит 3Fe2O3.4H2O, лимонит 2Fe2O3.3H2O, ксантосидерит Fe2O3.2H2O и лимнит Fe2O3.3H2O (твердые р-ры воды в гётите).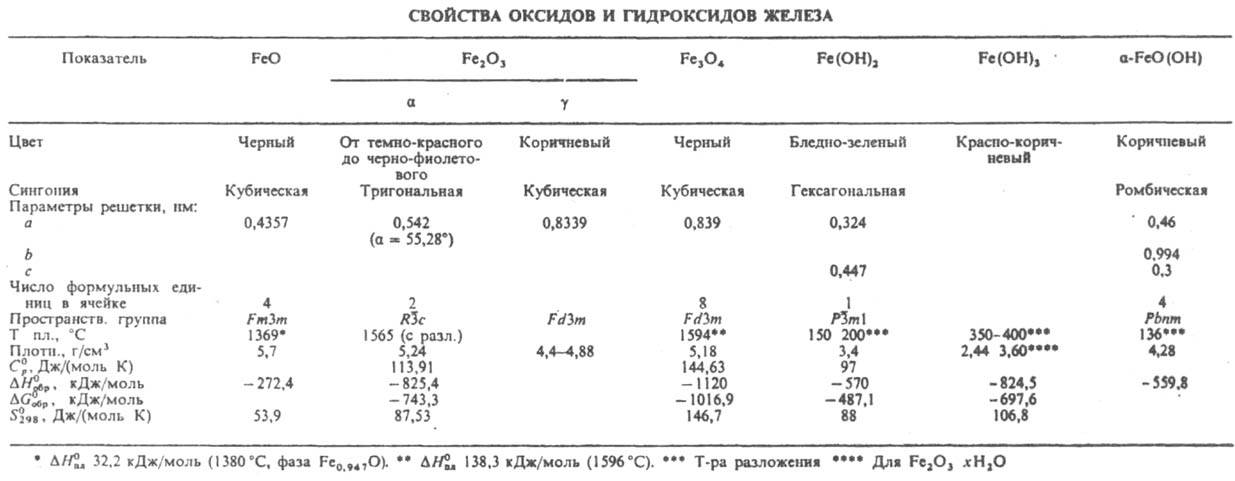
Лимнит совпадает по составу с искусств. гидрогелем Fe(OH)3, получаемым осаждением щелочью из р-ров солей Fe(III). При прокаливании гидроксиды Fe превращаются в a-Fe2O3. Гидроксид Fe(OH)3 - очень слабое основание; амфотерен, при оглавлении со щелочами или основными оксидами образуют соли не выделенной в своб. состоянии железистой к-ты НFеО2 - ферраты(Ш), или ферриты, напр. NaFeO2. При окислении Fe(OH)3 в щелочной среде сильными окислителями образуются соли не существующей железной к-ты H2FeO4 (триоксид FeO3 также неизвестен) - ферраты(VI), напр. K2FeO4, - красно-фиолетовые кристаллы; при 120-200 °С разлагаются на Fe2O3, M2O и О2; более сильные окислители, чем КМnО4. Прир. оксиды и гидроксиды Fe - сырье в произ-ве Fe, природные и синтетические - минер. пигменты (см. Железная слюдка, Железооксидные пигменты, Железный сурик, Мумия, Охры, Умбра); FeO - промежут. продукт в произ-ве Fe и ферритов, компонент керамики и термостойких эмалей; a-Fe2O3 - компонент футеровочной керамики, цемента, термита, поглотит. массы для очистки газов, полирующего материала (крокуса), используют для получения ферритов; g-Fe2O3 - рабочий слой магн. лент; Fe3O4- материал для электродов при электролизе хлоридов щелочных металлов, компонент активной массы щелочных аккумуляторов, цветного цемента, футеровочной керамики, термита; Fe(OH)2-промежут. продукт при получении железа оксидов и активной массы железоникелевых аккумуляторов; Fe(OH)3 - компонент поглотительной массы для очистки газов, катализатор в орг. синтезе.
Литература
см. при ст. Железо. Е. Ф. Вeгман.
Синонимы/примеры:*
Железа(II) оксид; Железа(III) оксид; Железа(II,III) оксид; Гематит; Магнетит; Вюстит
*подобраны ИИ, возможны неточности
Ещё по теме
Оксид железа (VIII) — свойства и получение
Железа (II, III) оксид — характеристики и свойства
Железа окислы — свойства и применение
Гидроксид железа (III) — основные характеристики
Железа (II) оксид — основные характеристики
Железо (II) гидроксид — свойства и характеристики
Железа (II) фторид — характеристики и свойства
Железа (III) фторид — свойства и характеристики
Железа (III) сульфат — характеристики и свойства
Сульфид железа (II) — основные характеристики
Железа (III) хлорид — свойства и характеристики
Железа (II) иодид — свойства и характеристики
Железо — от древности до наших дней
Гематит — характеристики и свойства
