Ферриты
ФЕРРИТЫ, сложные оксиды железа(Ш) с более основными оксидами др. металлов. Иногда ферритами наз. вообще все ферримагнетики независимо от их хим. природы. Практически важные ферриты относятся к след, структурным группам.
Ферриты со структурой шпинели имеют общую ф-лу 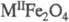 , где МII - Ni, Со, Mn, Mg, Cu, Fe, Zn, Cd. Они кристаллизуются в кубич. кристаллич. решетке, пространств. группа Fd3m, z = 8. К этой группе относится также феррит лития LiFe5O8 (можно считать, что в нем ионы M2+ замещены Li+0,5 + Fe3+0,5)· B нормальных шпинелях ионы M2+ расположены в октаэдрич. узлах, а ионы Fe3+ - в тетраэдрических. В обращенных шпинелях половина ионов Fe3+ находится в октаэдрич. позициях, а другая половина этих ионов и ионы M2+ - в тетраэдрических, занимая их статистически. Большей частью существуют смешанные шпинели, в к-рых оба вида ионов располагаются и в тех и в других позициях. Ферриты со структурой шпинели могут растворять значит. кол-ва Fe2O3. Они могут образовывать непрерывные твердые р-ры друг с другом, Fe3+ может частично замещаться др. ионами - Al, Cr3+, Ga, In, Sc, а также Ti4+ и т.д.
, где МII - Ni, Со, Mn, Mg, Cu, Fe, Zn, Cd. Они кристаллизуются в кубич. кристаллич. решетке, пространств. группа Fd3m, z = 8. К этой группе относится также феррит лития LiFe5O8 (можно считать, что в нем ионы M2+ замещены Li+0,5 + Fe3+0,5)· B нормальных шпинелях ионы M2+ расположены в октаэдрич. узлах, а ионы Fe3+ - в тетраэдрических. В обращенных шпинелях половина ионов Fe3+ находится в октаэдрич. позициях, а другая половина этих ионов и ионы M2+ - в тетраэдрических, занимая их статистически. Большей частью существуют смешанные шпинели, в к-рых оба вида ионов располагаются и в тех и в других позициях. Ферриты со структурой шпинели могут растворять значит. кол-ва Fe2O3. Они могут образовывать непрерывные твердые р-ры друг с другом, Fe3+ может частично замещаться др. ионами - Al, Cr3+, Ga, In, Sc, а также Ti4+ и т.д.
Ферриты со структурой граната кристаллизуются в кубич. кристаллич. решетке, пространств. группа Ia3d, z = 8, имеют общую ф-лу R3Fe5O12, где R - РЗЭ от Sm до Lu, а также Y. Важнейший из них - иттрий-железный гранат Y3Fe5O12 (см. Гранаты синтетические). В структуре этих ферритов ионы РЗЭ занимают додекаэдрич. позиции, 3/5 ионов Fe3+ -тетраэдрические, остальные 2/5 - октаэдрические. Ионы R могут частично замещаться ионами РЗЭ с большими ионными радиусами (Pr, Nd, La, но не Ce), а также Bi и двухвалентными ионами Ca, Sr, Mn (в этом случае часть Fe3+ замещается ионами с большим зарядом - Sn4+, Zr4+, Ge4+, Ti4+, Si4+ и даже V5+ и т. п.). Железо в ферритах-гранатах частично может замещаться Al, Ga, Cr3+, In, Sc, причем Al и Ga преим. занимают тетраэдрические, а остальные - октаэдрич. позиции.
Гексаферриты -ферриты с гексагон. структурой типа минерала магнетоплюмбита PbFe12O19 (пространств, группа Р63/ттс)или родственной ей. Различают неск. типов этих ферритов, в частности BaFe12O19 (обозначается M, часто его называют ферроксдюром), BaM2Fe16O27 (обозначение W, эти ферриты и последующие часто наз. феррокспланами), BaM2F12O22 (обозначение Y), Ba3M2Fe24O41 (Z), Ba2M2Fe28O46 (X), Ba4M2Fe36O60 (V), где M - Fe2+, Mn, Ni, Со, Zn, Mg, возможна также комбинация, напр.. Li+ + Fe3+. Кристаллич. структуры гекса-ферритов построены из шпинельных блоков, разделенных гексагон. блоками, в к-рых расположены ионы Ba (они могут замещаться частично или полностью ионами Ca, Sr или Pb). Возможно замещение ионов Ba трехзарядными ионами, напр. La, при этом равное кол-во ионов Fe3+ замещается на Fe2+ . Возможно также замещение ионов Fe ионами Al, Ga или комбинацией двух- и четырехзарядных ионов.
Ортоферритами наз. группу ферритов с ромбич. структурой типа искаженной структуры минерала перовскита CaTiO3 (пространств. группа Pcmn, z = 4). Их ф-ла RFeO3, где R -РЗЭ. Структура ортоферритов, подобно другим ферритам, допускает разнообразные изоморфные замещения. Если вышеописанные группы ферритов все являются ферримагнетиками, ортоферриты - антиферромагнетики и только при очень низких т-рах (неск. град. К и ниже) становятся ферримагнетиками.
Ферриты, как правило,- кристаллич. в-ва с сравнительно высокой твердостью и высокими т-рами плавления. Они не раств. в воде и орг. р-рителях, разлагаются к-тами. Устойчивы на воздухе, но при т-рах 1000 0C и выше могут диссоциировать, а содержащие Fe2+ и Mn2+ - окисляться. Соотношение катионов и анионов в ферритах может отличаться от стехиометрического при избытке или недостатке кислорода.
Поликристаллич. ферриты производят по технологии получения керамики спеканием (при т-рах от 900 до 1500 0C на воздухе или в спец. атмосфере) смесей оксидов или карбонатов, совместно упаренных р-ров солей (нитратов, сульфатов, двойных сульфатов типа шенитов) или совместно осажденных гидроксидов, оксалатов, карбонатов. Монокристаллы ферритов выращивают методами Вернейля, Чохральского, зонной плавки (см. Монокристаллов выращивание)обычно под давлением O2 неск. МПа или неск. десятков МПа. Чаще используют гидротермальное выращивание в р-рах NaOH, Na2CO3, NH4Cl или смеси хлоридов под давлением от 20 до 120 МПа либо выращивание из р-ров в расплаве (смеси PbO + PbF2, PbO + B2O3, BaO + B2O3 или более сложные) при применении в качестве исходных в-в смеси оксидов. Пленки ферритов со структурой шпинели выращивают обычно методом хим. транспортных р-ций с галогеноводородами (HCl) в качестве носителя. Пленки ферритов- фанатов и гексаферритов выращивают методом жидкостной эпитаксии из р-ров в расплаве, а также путем разложения паров, напр, 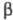 -дикетонатов металлов.
-дикетонатов металлов.
Ферриты используют в качестве магн. материалов в радиотехнике, электронике, автоматике, вычислительной технике (феррито-вые антенны, сердечники, элементы памяти и т.д.). Помимо описанных, известны ферриты и др. составов и структур, напр. для щелочных металлов MIFeO2, для щел.-зем. M2IIFe2O5 и т.д. Многие ферриты входят в состав шлаков, спец. цементов и т. п.
Лит.: Рабкин Л.И., Соскин С.А., Эпштейн Б.Ш., Ферриты. Строение, свойства, технология производства, Л., 1968; Журавлев Г.И., Химия и технология ферритов, Л., 1970; Левин Б.E., Третьяков Ю.Д., Л е т ю к Л. M., Физико-химические основы получения, свойства и применение ферритов, M., 1979; Летюк Л.М., Журавлев Г.И., Химия и технология ферритов, Л., 1983. п. И. Федоров.
