Электронные спектры
ЭЛЕКТРОННЫЕ СПЕКТРЫ, мол. спектры, обусловленные квантовыми переходами из одного электронного состояния молекулы в другое. Переходы, при к-рых происходит поглощение кванта электромагн. излучения, образуют электронные спектры поглощения. Переходы, сопровождающиеся испусканием излучения, образуют электронные спектры испускания. Электронные спектры расположены, как правило, в видимой и УФ областях спектра, они являются ценным источником сведений о строении молекул и межмол. взаимодействиях.
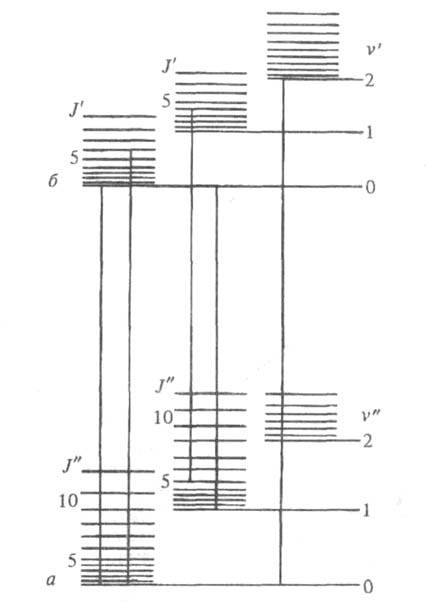
Рис. 1. Схема уровней энергии двухатомной молекулы: а и б - электронные уровни; v' и v" - квантовые числа колебат. уровней; J' и J" - квантовые числа вращат. уровней.
Существование у каждого из электронных состояний молекулы колебат. и вращат. уровней энергии приводит к тому, что электронный переход в электронных спектрах оказывается представленным не одной линией (как в случае атомов), а сложной системой линий, принадлежащих разным электронно-колебательно-вращат. переходам (рис. 1). Волновое число линии v такого спектра описывается выражением
v = vэл + vкол + vвр
Величина vэлпредставляет собой разность электронных энергий молекулы в минимумах поверхности потенц. энергии молекулы vкол и vвр - разности энергий соотв. для колебат. и вращат. уровней.
Классификация электронных состояний молекулы основывается на ряде признаков, из к-рых, прежде всего, следует отметить мулътиплетностъ и тип симметрии. Мультиплетность электронного состояния М задается квантовым числом S результирующего электронного спина (М = 2S+ 1) и характеризует кратность вырождения состояния по спину. Состояние с М = 1 (S = 0) наз. синглетным (обозначается буквой S), состояние с М=2 (S = 1/2) - дублетным (D), состояния с М=3 - триплетным (Т)и т.д. В магн. поле вырождение, состояний снимается: дублетное состояние расщепляется на два подуровня, триплетное - на три подуровня (см. Вырождение энергетических уровней). Электронное состояние с наименьшей энергией наз. основным (как правило, 50-состояние), остальные состояния - возбужденные (S1, S2, T1, T2 ...). У большинства известных молекул в своб. состоянии основное состояние является синглетным. Молекулы с нечетным числом электронов, к числу к-рых относится, напр., NO, имеют обычно дублетное основное состояние. Среди молекул, имеющих в качестве основного триплетное состояние, прежде всего выделяют мол. кислород О2.
Возбужденные состояния молекул, образовавшиеся в результате поглощения кванта света, как правило, быстро теряют энергию возбуждения (дезактивируются), причем механизмы дезактивации м. б. различными. Время жизни низших возбужденных S1-состояний колеблется для разных молекул между 10-10 и 10-7 с, для T1 состояний от 0,0001 с до неск. секунд. Лежащие более высоко по энергии возбужденные состояния часто дезактивируются безызлучательно и имеют времена жизни менее 10-11 с.
Электронные состояния двухатомных и линейных многоатомных молекул классифицируют также по величине проекции их результирующего орбитального (углового) момента ML на ось молекулы. Состояния с разл. ML , принято обозначать буквами греч. алфавита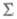 (ML = 0), П (ML = 1),
(ML = 0), П (ML = 1), (ML = 2) и т. д. Такая классификация, по существу, определяется осевой симметрией линейных молекул.
(ML = 2) и т. д. Такая классификация, по существу, определяется осевой симметрией линейных молекул.
Классификация состояний нелинейных молекул также проводится часто по симметрии ядерной подсистемы (перестановочной симметрии для тождественных ядер и точечной симметрии, напр. для их равновесных конфигураций; см. Симметрия молекул). Наличие точечной группы симметрии позволяет установить характер преобразований волновых ф-ций при операциях симметрии. Так, если молекула обладает центром симметрии, волновые ф-ции одних электронных состояний сохраняют свой вид при операциях инверсии, тогда как волновые ф-ции других состояний при этом меняют знак. В первом случае говорят о четном состоянии, к-рое обозначают нижним индексом "g", во втором - о нечетном состоянии (индекс "и").
Отыскание волновых ф-ций, описывающих электронные состояния молекулы, производится с помощью методов квантовой химии (см., напр., Молекулярных орбиталей методы). Часто волновая ф-ция строится в одноэлектронном приближении, когда мол. орбитали (МО) записываются в виде линейной комбинации атомных орбиталей (см. ЛКАО-приближение). При качеств. рассмотрении электронно-возбужденных состояний часто ограничиваются учетом их симметрии и указанием того, как меняются МО исходного электронного состояния при возбуждении (при переходе в конечное состояние). При т. наз. одноэлектронном переходе электрон одной из орбиталей, напр. или
или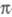 -орбитали либо п-орбитали неподеленной пары электронов, меняет свое состояние, переходит на вакантную орбиталь (обозначается звездочкой:
-орбитали либо п-орбитали неподеленной пары электронов, меняет свое состояние, переходит на вакантную орбиталь (обозначается звездочкой: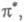
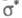 либо
либо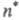 ). В зависимости от того, с какой занятой орбитали на какую вакантную орбиталь переходит электрон, возникают переходы типа
). В зависимости от того, с какой занятой орбитали на какую вакантную орбиталь переходит электрон, возникают переходы типа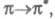
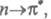
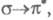
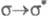 и т. п.
и т. п.
Правила отбора. В электронных спектрах проявляются далеко не все энергетически возможные для молекулы переходы. В случае одноэлектронных возбуждений разрешенными, т. е. имеющими отличную от нуля интенсивность линии в электронном спектре, являются переходы между состояниями одинаковой мультиплетности, напр. между синглетными состояниями (S S)или между триплетными состояниями (Т
S)или между триплетными состояниями (Т Т), тогда как интеркомбинационные переходы типа S
Т), тогда как интеркомбинационные переходы типа S Т запрещены. Имеются запреты и по типам симметрии волновых ф-ций состояний.
Т запрещены. Имеются запреты и по типам симметрии волновых ф-ций состояний.
Интенсивность полосы в электронном спектре определяется прежде всего вероятностью перехода между электронными состояниями, к-рая, в свою очередь, связана с дипольным моментом перехода Р:
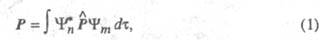
где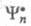 и
и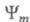 - волновые ф-ции исходного и конечного состояний;
- волновые ф-ции исходного и конечного состояний;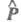 - оператор дипольного момента (см. Квантовые переходы). Интеграл берется по пространств. координатам и спиновым переменным всех электронов и ядер (
- оператор дипольного момента (см. Квантовые переходы). Интеграл берется по пространств. координатам и спиновым переменным всех электронов и ядер (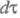 - элемент пространства всех этих переменных). Волновую ф-цию
- элемент пространства всех этих переменных). Волновую ф-цию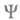 в грубом приближении Борна-Оппенгеймера (см. Адиабатическое приближение)представляют в виде произведения ф-ций
в грубом приближении Борна-Оппенгеймера (см. Адиабатическое приближение)представляют в виде произведения ф-ций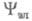 (зависит от координат электронов) и
(зависит от координат электронов) и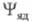 (зависит от координат ядер). Тогда выражение (1) принимает вид:
(зависит от координат ядер). Тогда выражение (1) принимает вид:
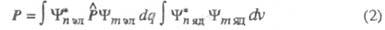
(dq и dv - элементы пространства соотв. электронных и ядерных переменных). Величина Р не равна нулю, если не равен нулю ни один из интегралов в выражении (2). Т. к. оператор дипольного момента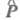 не зависит от спиновых переменных, первый интеграл, вообще говоря, не равен нулю, в частности, если состояния имеют одинаковую мультиплетность. Интеркомбинационные переходы между состояниями разной мультиплетности, хотя и наблюдаются в действительности, имеют очень малую вероятность. Причиной нарушения интеркомбинационного запрета служит спин-орбитальное взаимодействие, оно учитывается методами возмущений теории.
не зависит от спиновых переменных, первый интеграл, вообще говоря, не равен нулю, в частности, если состояния имеют одинаковую мультиплетность. Интеркомбинационные переходы между состояниями разной мультиплетности, хотя и наблюдаются в действительности, имеют очень малую вероятность. Причиной нарушения интеркомбинационного запрета служит спин-орбитальное взаимодействие, оно учитывается методами возмущений теории.
Второй интеграл означает, что в колебат. структуре разрешенного по симметрии электронного перехода будут активны только те колебания, для к-рых подынтегральная ф-ция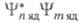 является полносимметричной или содержит полносимметричную составляющую. Запреты по симметрии нарушаются из-за электронно-колебательного взаимодействия.
является полносимметричной или содержит полносимметричную составляющую. Запреты по симметрии нарушаются из-за электронно-колебательного взаимодействия.
Колебательная структура электронных спектров. Энергетич. интервалы между колебат. уровнями энергии одного и того же электронного состояния молекулы существенно больше, чем между вращат. уровнями. Поэтому колебат. структуру электронных спектров принято называть грубой структурой. Каждый электронно-колебат. переход представлен в спектре системой линий, связанных с переходами между разными вращат. уровнями (Тонкая структура). Эта система линий регистрируется на приборах с высоким разрешением. Для сравнительно простых молекул, находящихся в газообразном состоянии, электронные спектры, полученные на приборах с малым или средним разрешением, состоят из колебательно-вращат. полос (полосатые спектры).
Электронные спектры многоатомных молекул обычно получают для конден-сир. фазы (жидкие и твердые р-ры, кристаллы). Эти спектры, как правило, имеют вид широких бесструктурных или слабо структурированных полос. Лишь при низких т-рах (обычно 77 К, 20 К или 4,2 К) в матрицах из замороженных н-парафинов (матрицы Шпольского) полосы распадаются на большое число линий или узких полос (квазилиний), отражающих колебат. структуру каждого из электронных переходов. В отличие от обычных широкополосных электронных спектров такие квазилинейчатые электронные спектры являются для молекул характеристичными. Для молекул в др. средах при низких т-рах удается получить тонкоструктурный спектр флуоресценции, если возбуждать молекулы лазером с длиной волны возбуждения, приходящейся на область чисто электронного перехода (см. Лазерная спектроскопия).
Спектры поглощения. У подавляющего числа известных многоатомных молекул электронные спектры поглощения определяются переходами из основного синглетного состояния S0 в возбужденные синглетные состояния Si (т. наз. S0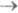 Si-спектры). При комнатной и более низких т-рах почти все молекулы находятся на нулевом колебат. уровне. Полосы поглощения обусловлены переходами с нулевого колебат. уровня S0-состояния на разл. колебательные уровни Si-состояний (рис. 2). Ввиду того, что возбужденные состояния быстро дезактивируются, в электронных спектрах поглощения обычно не наблюдаются полосы, связанные с переходами S1
Si-спектры). При комнатной и более низких т-рах почти все молекулы находятся на нулевом колебат. уровне. Полосы поглощения обусловлены переходами с нулевого колебат. уровня S0-состояния на разл. колебательные уровни Si-состояний (рис. 2). Ввиду того, что возбужденные состояния быстро дезактивируются, в электронных спектрах поглощения обычно не наблюдаются полосы, связанные с переходами S1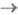 Si или T1
Si или T1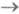 Тi. Их удается зарегистрировать Лишь с помощью импульсных ламп или лазеров, позволяющих создать на короткое время заметную заселенность T1- и S1-состояний. Получаемые при этом спектры T1
Тi. Их удается зарегистрировать Лишь с помощью импульсных ламп или лазеров, позволяющих создать на короткое время заметную заселенность T1- и S1-состояний. Получаемые при этом спектры T1 Ti- и S1
Ti- и S1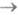 Si -поглощения наз. спектрами наведенного поглощения.
Si -поглощения наз. спектрами наведенного поглощения.
Поглощение света отдельно взятой молекулой - анизотропный процесс. Дихроизм поглощения для кристаллов, ориентированных пленок, жидких кристаллов принято характеризовать величиной d:
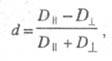
где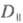 и
и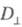 - оптич. плотности для линейно поляризованного света определенной длины волны с плоскостью поляризации, соотв. параллельной и перпендикулярной выделенному в в-ве направлению, напр. оси ориентации (растяжения) пленки. Зависимость
- оптич. плотности для линейно поляризованного света определенной длины волны с плоскостью поляризации, соотв. параллельной и перпендикулярной выделенному в в-ве направлению, напр. оси ориентации (растяжения) пленки. Зависимость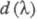 наз. спектрами дихроизма.
наз. спектрами дихроизма.
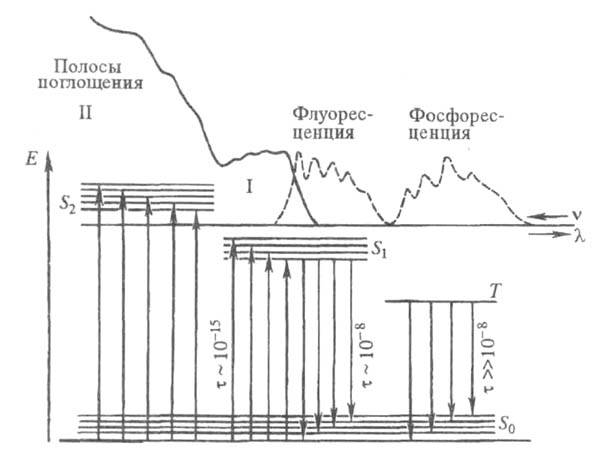
Рис. 2. Электронные спектры испускания (I) и поглощения (II). Указаны времена жизни (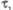 с) и типы (S0, S1, S2, T1) энергетач. состояний. Е - энергия;
с) и типы (S0, S1, S2, T1) энергетач. состояний. Е - энергия;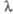 - длины волн; v - волновые числа линий поглощения или испускания.
- длины волн; v - волновые числа линий поглощения или испускания.
Весьма часто в многоатомных молекулах можно выделить сравнительно небольшие фрагменты, наз. хромофорными группами (хромофорами), к-рые в осн. ответственны за поглощение излучения. Электронное возбуждение при этом определяется гл. обр. изменением электронного распределения именно в локальных областях этих групп.
Поглощение света в-вом характеризуют обычно пропусканием, равным отношению интенсивностей прошедшего и падающего пучков, либо коэф. экстинкции, связанным с логарифмом пропускания (см. Абсорбционная спектроскопия). Полосам поглощения в электронных спектрах соответствуют молярные коэф. экстинкции от 103 до 106, тогда как в случае, напр., запрещенных по симметрии электронных переходов эти коэф. обычно не превышают 10 - 102.
Спектры испускания. Многоатомные молекулы в конденсир. фазе способны заметно испускать свет лишь при переходах из S1 - и T1 состояний. Испускание, связанное с излучат. переходом S1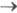 S0, получило назв. флуоресценции, а связанное с переходом T1
S0, получило назв. флуоресценции, а связанное с переходом T1 S0 - фосфоресценции (см. Люминесценция). Возбужденные молекулы до акта испускания света успевают частично дезактивироваться и оказываются на нулевом колебат. уровне S1 или T1 состояния.
S0 - фосфоресценции (см. Люминесценция). Возбужденные молекулы до акта испускания света успевают частично дезактивироваться и оказываются на нулевом колебат. уровне S1 или T1 состояния.
При возбуждении в-ва линейно поляризованным светом испускание оказывается анизотропным. Степенью поляризации излучения наз. величину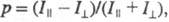 где
где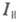 интенсивность той компоненты излучения, к-рая поляризована так же, как и возбуждающий свет, а
интенсивность той компоненты излучения, к-рая поляризована так же, как и возбуждающий свет, а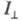 - интенсивность перпендикулярно поляризованной этому направлению компоненты. Степень поляризации излучения каждого в-ва в р-ре зависит, в частности, от природы р-рителя и от длины волны возбуждающего света.
- интенсивность перпендикулярно поляризованной этому направлению компоненты. Степень поляризации излучения каждого в-ва в р-ре зависит, в частности, от природы р-рителя и от длины волны возбуждающего света.
Применение электронных спектров. По интенсивности полос электронных спектров можно судить о концентрации данного в-ва в р-ре (см. Спектрофотометрия). Так, по спектрам поглощения удается зарегистрировать следы в-ва до 10-4-10-6 моль/л, тогда как при анализе смесей с использованием замороженных матриц Шпольского можно подчас определить неск. индивидуальных компонентов смеси с абс. чувствительностью до 10-11 г (концентрация в-ва в таких матрицах обычно составляет 10-5-10-6 моль/л). На основе квазилинейчатых спектров люминесценции разработан высокочувствит. и селективный мол. спектральный анализ сложных орг. смесей. По изменению интенсивности отд. полос судят об увеличении или уменьшении кол-ва отд. компонентов смеси при изменении условий (напр., рН среды), о наличии в системе тех или иных хромофорных групп и их взаимод., величине дипольного момента молекул, симметрии молекул и др. Электронные спектры, получаемые при низких т-рах в матрицах, позволяют судить о "замороженных" свободных радикалах и их превращениях, а при разрешенной колебат. структуре дают возможность определять спектроскопич. постоянные, напр. фундам. частоты колебаний для разл. электронных состояний.
Для этих же целей широко используют и электронные спектры молекул в газовой фазе, хотя детальная информация м. б. получена в осн. лишь для малоатомных молекул. Для получения информативных электронно-колебат. спектров паров многоатомных молекул разработан спец. метод, основанный на охлаждении в-ва в сверхзвуковой струе инертного газа. Совр. методы анализа электронно-колебат. спектров позволяют получать сведения о тонких эффектах спин-орбитальных, электронно-колебат. и электрон-фононных взаимод. в возбужденных электронных состояниях молекулы, об орбитальной природе этих состояний.
Для получения электронных спектров используют разл. комбинации методов, напр. возбуждение молекул световыми импульсами малой длительности, в т.ч. пико- и фемтосекундными с послед. зондированием образовавшихся возбужденных состояний излучением другой частоты. Подобные методы позволяют следить за эволюцией мол. систем во времени, в частности при хим. превращениях.
Поскольку электронные спектры молекул зависят от условий их получения (фазовое состояние в-ва, т-ра образца, рН среды и др.), они применяются для исследований межмолекулярных взаимодействий и их связи с внеш. условиями, особенно в тех случаях, когда эти взаимод. велики (напр., при образовании водородных связей).
Лит.: Ельяшевич М. А., Атомная и молекулярная спектроскопия, М., 1962; Герцберг Г., Электронные спектры и строение многоатомных молекул, пер. с англ., М., 1969; Свердлова О.В., Электронные спектры в органической химии, 2 изд., Л., 1985.
Р. H. Нурмухаметов.
