Гексахлорэтан
ГЕКСАХЛОРЭТАН (перхлорэтан) С2С16, мол. м. 236,74; бесцв. кристаллы с камфарным запахом. Имеет три кристаллич. модификации: до 43,6°С устойчива ромбич. модификация, при 43,6-71,1 °С-триклинная, выше 71,1 °С- кубическая. Т. пл. 187°С (в закрытом капилляре), т. кип. 185,6°С (возгоняется); d420 2,091; давление пара (кПа) 0,1 (32,7 °С), 1,33 (73,5°С), 13,3 (124,2°С); Ср° 0,728 кДж/(кг*К) (жидкость; 25°С), 0,557 кДж/(кг*К) (пар; 25°С);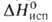 215,5 кДж/кг,
215,5 кДж/кг,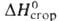 - 460,24 Дж/моль, для газа - 519,23 Дж/моль,
- 460,24 Дж/моль, для газа - 519,23 Дж/моль,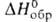 - 141,42 кДж/моль,
- 141,42 кДж/моль,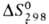 396,52 Дж/(моль*К). Гексахлорэтан умеренно раств. в спирте и эфире, хорошо - в CS2, р-римость в воде 0,005% (22,3 °С); образует азеотропную смесь с водой (т. кип. 99 °С, 33,9% гексахлорэтана).
396,52 Дж/(моль*К). Гексахлорэтан умеренно раств. в спирте и эфире, хорошо - в CS2, р-римость в воде 0,005% (22,3 °С); образует азеотропную смесь с водой (т. кип. 99 °С, 33,9% гексахлорэтана).
Энергия связей: С—С1 299,99 к Дж/моль, С—С 263,59 кДж/моль; длина связей С—С1 0,174 нм, С—С 0,157нм, валентный угол С1СС1 109,3°.
Гексахлорэтан гидролизуется твердой щелочью при 200 °С и выше, а также спиртовым р-ром щелочи до щавелевой к-ты. В газовой фазе при 500-600 °С (или при 350-450 °С в присут. активиров. угля) разлагается с образованием СС14 и тетра-хлорэтилена. Под действием цинка в водной среде превращ. в тетрахлорэтилен.
Получают гексахлорэтан хлорированием полихлорэтанов (270-290 °С; кат.-активиров. уголь, паровая фаза) или тетрахлорэтилена (100-110°С; кат.-FеС13, жидкая фаза). В парофазном процессе гексахлорэтан выделяют десублимацией, в жидкофазном-перекристаллизацией из спирта или бензола.
Гексахлорэтан применяют в произ-ве хладона 113, таблеток для дегазации при отливке алюминиевых деталей, для получения дымообразующих смесей.
Гексахлорэтан не горит и не взрывается. ПДК 10 мг/м3, в воде водоемов санитарно-бытового водопользования 0,01 мг/л.
Литература
Промышленные хлорорганические продукты. Справочник, под ред. Л.А. Ошина, М., 1978, с. 196-213. Ю.А. Трчггр.
