Фосфор белый
Внешний вид:
бесцветн. кубические кристаллы Кристаллические модификации, цвет растворов и паров:
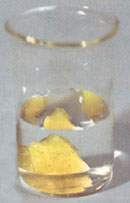 Белый фосфор (на фото, под слоем воды) или альфа-фосфор или фосфор-III - это белая прозрачная воскообразная масса (при охлаждении становится хрупкой) или прозрачные кристаллы похожие на алмазы. При -76,9 С переходит в бета-модификацию белого фосфора (фосфор-IV) с гексагональной решеткой (плотность 1,88 г/см3, теплота перехода из фосфора-III в фосфор-IV = 0,522 кДж/моль). Молекула тетраэдрическая P4. Выше 800 С диссоциирует на P2. Расплав легко переохлаждается.
Белый фосфор (на фото, под слоем воды) или альфа-фосфор или фосфор-III - это белая прозрачная воскообразная масса (при охлаждении становится хрупкой) или прозрачные кристаллы похожие на алмазы. При -76,9 С переходит в бета-модификацию белого фосфора (фосфор-IV) с гексагональной решеткой (плотность 1,88 г/см3, теплота перехода из фосфора-III в фосфор-IV = 0,522 кДж/моль). Молекула тетраэдрическая P4. Выше 800 С диссоциирует на P2. Расплав легко переохлаждается.Брутто-формула (система Хилла): P4
Формула в виде текста: P4
Молекулярная масса (в а.е.м.): 123,9
Температура плавления (в °C): 44,1
Температура кипения (в °C): 257
Растворимость (в г/100 г или характеристика):
ацетон: 0,14 (25°C)ацетон: 0,22 (40°C)
бензол: 3,2 (20°C)
бензол: 5,75 (40°C)
бензол: 7,9 (60°C)
вода: 0,0003 (15°C)
диэтиловый эфир: 1,04 (20°C)
диэтиловый эфир: 1,39 (25°C)
диэтиловый эфир: 2 (35°C)
сероуглерод: 434 (0°C)
сероуглерод: 630 (5°C)
сероуглерод: 880 (10°C)
тетрахлорметан: 1,27 (20°C)
тетрахлорметан: 1,82 (40°C)
этанол: 0,31 (18°C)
Способы получения:
1. Накаливанием фосфата кальция с песком и углем в электрической печи при 1300-1500 С.2. Реакцией фосфина с трихлоридом фосфора получают фосфор особой чистоты (реакция обратима).
Плотность:
1,83 (20°C, г/см3)Давление паров (в мм.рт.ст.):
1 (75°C)10 (123°C)
100 (190°C)
Магнитная восприимчивость (в мм3/кг):
-0,088600000000000000 (293 К)Стандартная энтальпия образования ΔH (298 К, кДж/моль):
0 (т)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
0 (т)Стандартная энтропия образования S (298 К, Дж/моль·K):
41,1 (т)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):
23,8 (т)Энтальпия плавления ΔHпл (кДж/моль):
0,659Летальная доза (ЛД50, в мг/кг):
11,5 (мыши, перорально)Критическая температура (в °C):
695Критическое давление (в МПа):
8,1Применение:
Основная часть фосфора (около 90%) идет на производство фосфорной кислоты. Для синтеза органических и неорганических соединений фосфора. Дымообразующее и зажигательное средство; для изготовления трассирующих боеприпасов.
История:
Название присходит от греческого фосфорос - "светоносный".
Получил в 12 веке арабский алхимик Ахад Бехиль. В Европе впервые был получен Х. Брандом в 1669 г.
Дополнительная информация:
На воздухе легко воспламеняется при 34 С. В расплавленном виде хорошо растворяет серу; реакция с ней начинается только при достаточном нагревании. Светится в темноте за счет медленного окисления воздухом. В парах в электрическом разряде реагирует с азотом с образованием смеси нитридов.
Сродство к электрону 0,6 эВ, электроотрицательность по Полингу 2,10. Атомный радиус 0,134 нм. Среднее содержание в земной коре 0,105% по массе. Содержание в воде морей и океанов 0,07 мг/л. Ширина запрещенной зоны 2,1 эВ.
- "Химическая энциклопедия" т.5 М.: Советская энциклопедия, 1999 стр. 136, 144-147
- "Энциклопедия для детей" т.17: Химия, М.:Аванта+, 2004 стр. 226
- Гурвич Я.А. "Справочник молодого аппаратчика-химика" М.:Химия, 1991 стр. 52
- Некрасов Б.В. "Основы общей химии" т.1 М.:Химия, 1973 стр. 437, 457
- Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 107
