Сопряжение простых и кратных связей
Кроме сопряжения между кратными связями, рассмотренного на стр. 392, возможно также сопряжение кратных связей с простыми. Некоторые факты, свидетельствующие о взаимодействии простой и двойной связи, были известны в органической химии уже давно. В частности, эффект этого рода был изучен В. В. Марковниковым на примере взаимодействия метильной группы с группой —СН=СН— в олефинах, что привело его к открытию правила присоединения галоидоводородов к непредельным углеводородам (правило Марковникова). Позднее появились новые важные факты. Так, в 1935 г. Бэкер и Натан, изучая реакцию замещенных бензилбромидов с пиридином, показали, что алкильные заместители проявляют свои электронодонорные свойства в последовательности
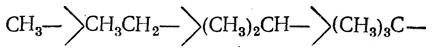
обратной их положительным индукционным эффектам (ср. стр. 145).
Впоследствии оказалось, что такое явление наблюдается во всех случаях, когда алкильные заместители связаны с системой сопряженных двойных связей (или с бензольным кольцом). Оно объясняется тем, что σ-электроны связей С—Н легче, чем σ-электроны связей С—С, взаимодействуют с сопряженными с ними π-электронами связей С=С. Так, например, в системе
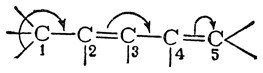
смещение электронной плотности в направлении, указанном стрелками, максимально, если атом C1 связан с тремя водородными атомами; по мере уменьшения числа связанных с C1 атомов водорода эффект ослабевает. Таким образом, электронодонорные свойства указанной системы атомов, изображенной в следующем виде
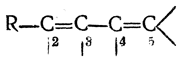
будут максимальны при R—СН3 и минимальны при R=(СН3)3С Взаимодействие σ-электронов связей С—Н с π-электронами системы сопряженных связей получило название гиперконъюгации (сверхсопряжение).
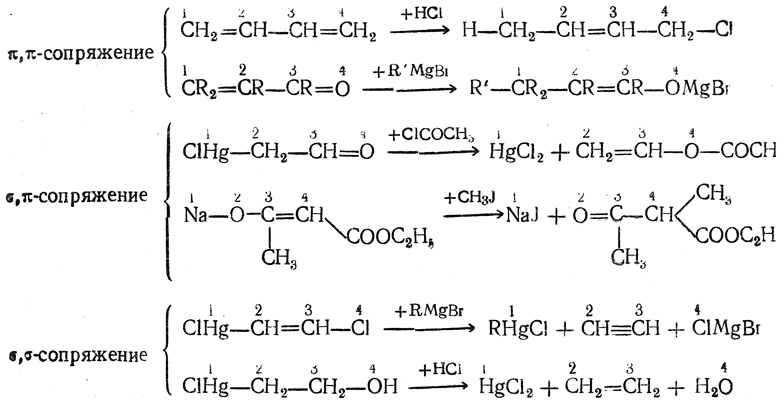
Гиперконъюгация — лишь один из видов сопряжения простых и кратных связей. Более широкие представления о сопряжении простой связи с двойной (σ,π-сопряжение) и двух простых связей (σ,σ-сопряжение) развиты А. Н. Несмеяновым, указавшим на ряд аналогий химического поведения π,π- σ,π- и σ,σ-сопряженных систем, например в реакциях 1,4-присоединения.
Простейшим примером молекулы, где связь Н—С сопряжена со связью С=С, может служить молекула пропилена. В этой молекуле благодаря влиянию метильной группы возникает электрическая асимметрия двойной связи
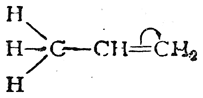
которая выражается, например, в дипольном моменте молекулы пропилена (0,35 D). Смещение π-электронной пары, очевидно, связано с некоторым смещением σ-электронов связей С—Н метильной группы в том же направлении. Обычно это изображают следующим образом:
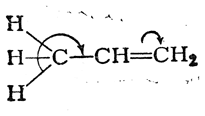
В этом и заключается статический эффект сопряжения простых и двойных связей (σ,π-сопряжение).
Очевидно, что при таком распределении электронного облака в молекуле несколько изменится химический характер как двойной связи, так и связей С—Н метильной группы. Поэтому следует ожидать, что атомы водорода метильной группы пропилена будут более реакционноспособны, чем, например, в пропане. Экспериментальные данные подтверждают это предположение. Так, например, атомы водорода метильной группы пропилена способны легко отщепляться в виде протонов в среде жидкого дейтероаммиака (ND3) и замещаться при этом на дейтерий. Кроме того, пропилен в присутствии трехфтористого бора или галогенидов меди, серебра, бериллия как катализаторов способен вступать с формальдегидом в реакцию типа альдольной конденсации
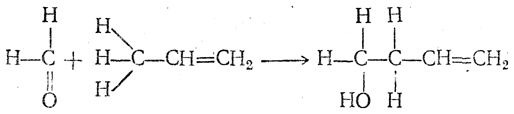
подобно альдегидам, содержащим водородные атомы в α-положении.
Известны и другие реакции, иллюстрирующие повышенную реакционную способность атомов водорода, связанных с α-углеродным (относительно двойной связи) атомом, сравнительно с атомами водорода предельных углеводородов,
В системах, содержащих связь С=О
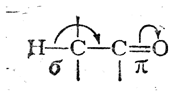
сопряжение σ- и π-связей выражено ярче вследствие более высокой электроотрицательности кислородного атома по сравнению с атомом углерода. Так, хорошо известна значительная реакционная способность атомов водорода, связанных с α-углеродным атомом в молекулах альдегидов, кетонов и сложных эфиров. Если в сопряженной системе
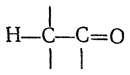
заменить водородный атом на другой, более поляризуемый атом, например на атом ртути, σ,π-сопряжение будет выражено сильнее. Такая картина наблюдается, например, в случае хлормеркурацетальдегида:
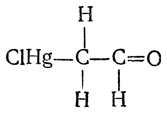
Сопряжение связей Hg—С и С=О достигает здесь такой степени, что ряд реакций этого вещества, протекающих с элиминированием ртути, идет не по месту разрыва связи Hg—С, а по кислородному атому группы С=О, т. е. с переносом реакционного центра, например:
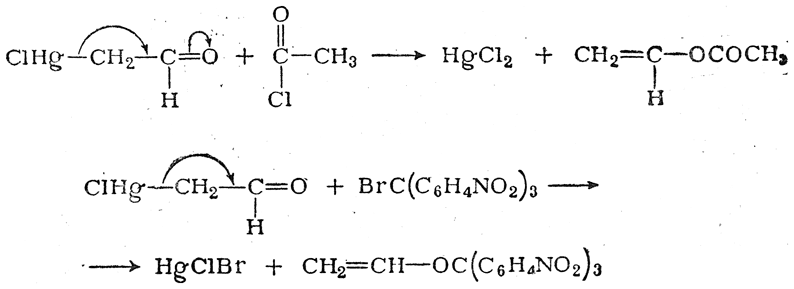
Сопряжение двух простых связей, разделенных одной простои или одной двойной связью (σ,σ-сопряжение), изученное главным образом на ряде частных примеров (продукты присоединения солей тяжелых металлов к этилену и ацетилену), оказалось аналогичным σ,π-сопряжению.
Таким образом, σ,π-сопряжение и σ,σ-сопряжение в своих главных чертах подобны π,π-сопряжению, хотя они и выражены слабее.
Это сходство особенно ясно видно при сопоставлении типичных реакций π,π-сопряженных систем с реакциями σ,π- и σ,σ-сопряженных систем: