Электронные представления о простых и кратных углерод-углеродных связях
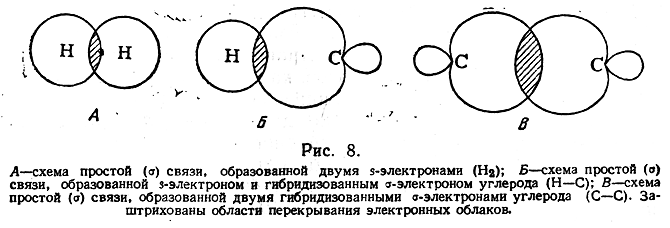
Согласно современным представлениям, необходимым условием для образования химической связи между двумя атомами является перекрывание облаков их электронов. Электрон образует связь в том направлении, в котором расположена наибольшая часть его облака, так что при этом осуществляется максимальное перекрывание облаков двух связующих электронов.
В случае простой связи (изображаемой одной валентной черточкой) максимальное перекрывание осуществляется по прямой, соединяющей два атома (рис. 8). Такая простая кова-лентная связь называется σ-связью, а электроны, ее образующие, — σ-электронами.
В молекуле этана, например, имеется семь σ-связей
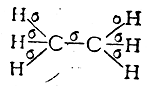
расположенных друг относительно друга под углом 109°28'. Атомы углерода в таких соединениях, как говорят, находятся в первом валентном состоянии (sр3-гибридизация).
В молекуле этилена, как это установлено с помощью физических методов исследования, пять σ-связей расположены друг относительно друга под углом 120° и находятся в одной плоскости:
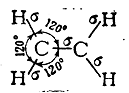
Однако при таком расположении связей в этилене у каждого атома углерода остается по одному неспаренному электрону. Они уже не могут образовать между атомами углерода вторую σ-связь, так как это сопровождалось бы нарушением принципа Паули. Поэтому такие неспаренные электроны атомов углерода образуют качественно иную связь. Перекрывание двух электронных облаков происходит так, что восьмерки этих облаков перпендикулярны плоскости, в которой расположены все шесть атомов молекулы этилена (рис. 9). Такая связь называется π-связью, а электроны, ее образующие, — π-электронами. Так как предполагается, что σ-связи в молекуле этилена образуются с участием гибридизованных электронов, а π-связь — с участием «чистых» р-электронов (т. е. из четырех электронов каждого углеродного атома гибридизованы один s-электрон и только два из трех р-электронов), то гибридизация электронов углеродного атома в молекуле этилена обозначается как sp2-гибридизация.
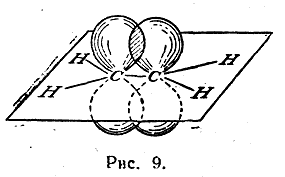
Строение молекулы этилена может быть также схематически представлено, как показано на рис. 10.
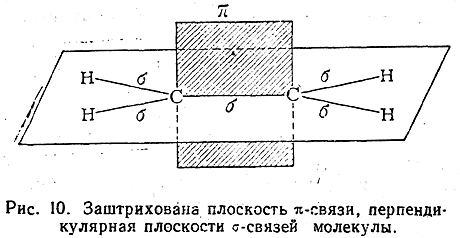
В молекуле этилена мы встречаемся с атомами углерода во втором валентном состоянии.
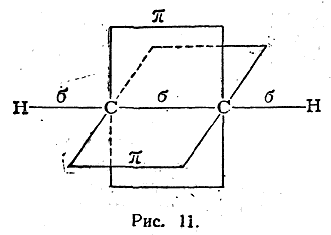
В молекуле ацетилена углерод находится в третьем валентном состоянии. В этой молекуле все четыре атома расположены на одной прямой и углы между σ-связями составляют 180° (sp-гибридизация). Электронные облака двух π-связей расположены вдоль пересекающихся взаимно-перпендикулярных плоскостей (рис. 11). Таким образом, согласно изложенным выше наглядным представлениям, две углерод-углеродные связи в молекуле этилена и три — в молекуле ацетилена по своему электронному строению не одинаковы. До сих пор, однако, не известно никаких химических или физических экспериментальных фактов, которые могли бы подтвердить это различие. Тот факт, что углеродные атомы, связанные двойными связями, способны легко присоединять только два атома водорода, галоида и т. п., так что одна из углерод-углеродных связей сохраняется, легко согласуется также и с предположением, что обе углерод-углеродные связи одинаковы. В самом деле, если по одной из таких одинаковых углерод-углеродных связей присоединяются, например, два атома водорода, то в результате этого характер второй оставшейся углерод-углеродной связи может измениться иона, отличаясь от двух имевшихся кратных связей в исходном соединении, может быть прочнее, чем каждая из них. На основе такого предположения можно объяснить, почему двойная связь легко присоединяет только два, а тройная — только четыре эквивалента.
Неравноценность связей могла бы быть установлена физическими методами исследования, из которых важное значение имеет, например, определение энергии связей С—С, С=С и С≡С Значения энергии этих связей составляют соответственно 79,3; 140,5; 196,7 ккал/моль (средние значения). Как видно, при образовании второй связи между углеродными атомами общая энергия связи между двумя атомами не становится вдвое большей, а возрастает лишь на 61,2 ккал/моль; отсюда делается вывод, что π-связь слабее σ-связи. Еще меньше увеличивается энергия связи между атомами углерода при возникновении третьей связи (на 56,2 ккал/моль).
Однако и из этих данных все же нельзя сделать однозначного вывода о неравноценности σ- и π-связей. Строго говоря, приведенный ход возрастания энергии связей между двумя атомами может свидетельствовать о различии σ- и π-связей только в том случае, если предварительно сделать допущение, что энергия простой связи С—С по крайней мере существенно не меняется, если рядом с ней возникает вторая связь (при переходе С—С -----> С=С), а затем и третья. Без такого предварительного допущения нельзя аргументировать различие σ- и π-связей приведенными величинами энергии их образования.
π-Связи широко распространены в органических соединениях, причем ими могут быть связаны друг с другом не только атомы углерода, но и атомы азота, сурьмы, мышьяка и т. п., а также атомы углерода с атомами кислорода, азота, серы и др.
В тех случаях, когда связь осуществляется между атомами, различающимися по электроотрицательности, она поляризована, т. е. электроны, ее образующие, смещены в сторону более электроотрицательного атома. При этом поляризация π-связи всегда больше поляризации σ-связи, связызающей те же атомы. Вместе с тем при такой поляризации электроны не переходят целиком из электронной оболочки одного атома в оболочку другого.
Поляризованная π-связь может быть рассмотрена на примере карбонильной группы >С= О. На основании экспериментальных исследований дипольных моментов большого числа альдегидов и кетонов известно, что дипольный момент карбонильной группы составляет примерно 2,7 D. Известно также, что дипольный момент σ-связи С—О (на основан.ии исследования простых эфиров) равен 1,2 D. Если бы поляризация π-связи была такого же порядка, то для карбонильной группы следовало бы ожидать дипольного момента, равного 1,2 + 1,2 = 2,4 D. Однако дипольный момент карбонильной группы в действительности превышает эту величину, а следовательно, π-связь поляризована в большей мере, чем σ-связь С—О. Если, с другой стороны, предположить, что π-связь поляризована до предела и, следовательно, в карбонильной группе имеется семиполярная связь
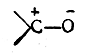
то в таком случае следовало бы ожидать дипольного момента порядка 5,7D (μ = 4,774 · 10-10 эл.-ст. ед. x 1,2·10-8 см=5,7288D). Следовательно, в карбонильной группе имеется лишь частичная поляризация π-связи. Обычно это изображают следующим образом:
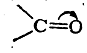
Изогнутая стрелка указывает направление смещения я-элек-тронов, т. е. направление поляризации π-связи.
В результате такой поляризации (а также отчасти и поляризации σ-связи) атом углерода приобретает некоторый (неполный) положительный заряд, а атом кислорода — некоторый отрицательный заряд:
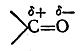
Наличие этих зарядов во многом определяет химическое поведение карбонильных соединений (течение реакций присоединения, замещения и др.).


