Углерод-углеродные связи в ароматических соединениях
В ароматических соединениях углерод-углеродные связи посвоим параметрам занимают обычно промежуточное положение междусвязями С—С и С=С. Они отличаются (в этих пределах) большим разнообразием, вследствие чего формулы многих органических соединений, изображенные в виде систем с чередующимися простыми и двойными углерод-углеродными связями, имеют существенные недостатки.
Даже для простейшего ароматического углеводорода — бензола формула с чередующимися простыми и двойными связями
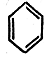
в ряде отношений оказывается неудовлетворительной. Согласно этой формуле, называемой формулой Кекуле, молекула бензола должна была бы иметь ось симметрии третьего порядка и форму неправильного шестиугольника, так как длина ординарной связи С—С обычно равна 1,54 А, а длина двойной связи С=С составляет лишь 1,32 А. В действительности же молекула бензола обладает осью симметрии шестого порядка, а все шесть углерод-углеродных связей имеют одинаковую длину 1,40 А, промежуточную между длиной простой и длиной двойной углерод-углеродной связи.
Попытки согласовать формулу Кекуле с экспериментальными данными посредством допущения неуловимо быстро совершающейся осцилляции связей
лишены физического обоснования.
Имеющиеся в настоящее время данные дают возможность принять следующую схему строения бензола: все шесть углеродных (и шесть водородных) атомов находятся в одной плоскости (факт экспериментальный), а облака π-электронов углеродных атомов перпендикулярны плоскости молекулы (и, следовательно, параллельны друг другу).
На рис. 12, А π-электроны условно обозначены стрелками. Различные направления стрелок отражают тот факт, что π-электроны соседних атомов углерода отличаются спинами. Облако каждого π-электрона перекрывается как облаком соседа слева,
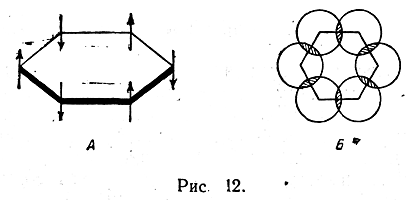
так и облаком соседа оправа. Эту особенность облака π-электронов бензольного кольца, не отраженную на рис. 12, А, можно видеть, если пространственную электронную модель молекулы бензола спроектировать на плоскость (рис. 12, Б). Таким образом, каждый углеродный атом бензольного кольца связан со своими двумя соседями не только σ-, но и π-электронами.
Легко видеть, что углерод бензольного кольца, как и углерод этилена, находится во втором валентном состоянии.
Структурную формулу бензола было бы логично изображать в виде
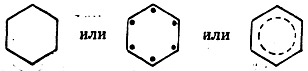
(точки во второй формуле обозначают π-электроны, пунктирный круг в третьей формуле — общее облако π-электронов). Однако для сохранения обычных представлений о четырехвалентноети углерода химики пользуются формулой Кекуле, отчетливо сознавая ее достоинства и недостатки. Как в этом можно убедиться из дальнейшего изложения, допускаемая условность вогромном большинстве случаев на сути дела не отражается. К тому же левую формулу целесообразнее сохранить для изображения алициклических соединений с шестичленным углеродным кольцом.
Для характеристики отдельных связей в ароматических соединениях часто используют понятие кратность связи. Если принять для связи С—С в этане кратность, равную 1, а для связи С=С в этилене — равную 2, то кратности связей в ароматических углеводородах обычно будут промежуточными между 1 и 2.
Кратность связи зависит от ее длины и электронной плотности. Так, например, при одинаковой электронной плотности двух связей большую кратность будет иметь более короткая.
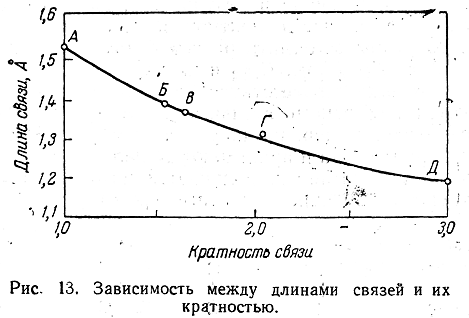
Определив экспериментально длину связи, можно предсказать ее кратность и, наоборот, вычислив кратности связей, можно предсказать их длину.
Зависимость между длинами и кратностью связей (вычисленной по методу молекулярных орбит) изображена на рис. 13, где даны точки для этана (А), графита (Б), бензола (В), этилена (Г) и ацетилена (Д).


