Ниобий
НИОБИЙ (от имени Ниобы- дочери Тантала в др.-греч. мифологии; лат. Niobium) Nb, хим. элемент V гр. периодич. системы, ат. н. 41, ат. м. 92,9064. В природе один стабильный изотоп 93Nb. Поперечное сечение захвата тепловыx нейтронов 1,15.10-28 м2. Конфигурация внеш. электронных оболочек атома 4s24p64d45s1; степени окисления + 5, реже + 4, + 3, + 2 и + 1; энергии ионизации при последоват. переходе от Nb0 к Nb7+ равны соотв. 6,882, 14,320, 25,05, 38,3, 50,6, 103 и 124,6 эВ; сродство к электрону 1,13 эВ; работа выхода электрона 4,01 эВ; электроотрицательность по Полингу 1,6; атомный радиус 0,145 нм, ионные радиусы (в скобках указано координац. число) Nb2+ 0,085 нм (6), Nb3+ 0,086 нм (6), Nb4+ 0,082 нм (6), 0,092 нм (8), Nb5 + 0,062 нм (4), 0,078 нм (6), 0,083 нм (7), 0,088 нм (8).
Содержание в земной коре 2.10-3% по массе. Встречается в природе обычно вместе с Та. Наиб. важные минералы -колумбит-танталит, пирохлор и лопарит. Колумбит-танталит (Fe,Mn)(Nb,Ta)2O6 содержит 82-86% оксидов Nb и Та. При содержании ниобия выше, чем Та, минерал наз. колумбитом, при обратном соотношении - танталитом. Пирохлор (Na,Ca,Ce)2(Nb,Ti)2(OH,F)O6 обычно содержит 37,5-65,6% Nb2O5; лопарит (Na,Ce,Ca,SrXNb,Ti)O3-8-10% Nb2O5. Минералы ниобия слабо парамагнитны и радиоактивны из-за примесей U и Th.
Колумбит встречается в изверженных пегматитах, биотитах и щелочных гранитах, иногда-в россыпных месторождениях (Нигерия), его часто добывают как побочный продукт обогащения оловянных концентратов. Пирохлор содержится в карбонатитах, щелочных породах (Канада), нефелин-сиенитовых пегматитах, в элювиальных продуктах выветривания сиенито-карбонатитов (Бразилия). Крупные залежи лопарита имеются в СССР.
Общие мировые запасы ниобия (без СССР) оценивались (1980) в 18 млн. т, в пром. месторождениях-ок. 3,4 млн. т (из них 3,2 млн.т в Бразилии).
Свойства. Ниобий-блестящий серебристо-серый металл; кри-сталлич. решетка объемноцентрир. кубическая типа a-Fe, а = 0,3294 нм, z = 2, пространств. группа Im3m; т. пл. 2477 °С, т. кип. ок. 4760 °С; плотн. 8,57 г/см3; С0р 24,44Дж/(моль.К); DH0пл 31,0 кДж/моль (2477 °С), DH0возг 720кДж/моль (0 К), DH0исп 662 кДж/моль (4760 °С); S0298 36,27 ДжДмоль•К); ур-ние температурной зависимости давления пара над жидким ниобием: lgр(Па) = 13,877-40169/T (2304 <= Т<= 2596 К); температурный коэф. линейного расширения 7,1.10-6К-1 (0-100 °С); теплопроводность 52,3 Вт/(м.К) при 20 °С и 65,2 Вт/(м.К) при 600 °С; r 1,522.10-9 Ом.м при 0°С, температурный коэф. r 3,95 х х 10-3 К-1 (0-100°С). Ниобий парамагнитен, уд. магн. восприимчивость + 2,28.10-6 (18 °С). Т-ра перехода в сверхпрово-дящее состояние 9,28 К.
Чистый ниобий легко обрабатывается давлением на холоду; жаропрочен; sраст 342 МПа (20 °С) и 312 МПа (800 °С); относит. удлинение 19,2% (20 °С) и 20,7% (800 °С); твердость по Бринеллю 450 МПа для чистого металла и 750-1800 МПа для технического. Примеси H,N,C и О снижают пластичность ниоби\ и повышают его твердость. В хрупкое состояние ниобий переходит при т-рах от — 100 до — 200°С.
Химически ниобий довольно устойчив. В компактном виде начинает окисляться на воздухе выше 200 °С, давая ниобия оксиды, взаимод. с Сl2 выше 200 °С, с F2 и Н2-выше 250 °С (интенсивно с Н2-при 360 °C), с N2-вышe 400 °С, с С и углеводородами-при 1200-1600 °С. На холоду не раств. в царской водке, соляной и серной к-тах, не реагирует с HNO3, Н3РО4, НСlО4, водным р-ром NH3. Устойчив к расплавл. Li, Na, К, Sn, Pb, Bi, а также Hg. Раств. во фтористоводородной к-те, ее смесях с HNO3, в расплавл. NH4HF2 и NaOH. Обратимо поглощает Н2, образуя твердый р-р внедрения (до 10 ат. % Н) и гидрид состава NbHx (x = 0,7-1,0) с ромбич. кристаллич. решеткой; для NbH0,761 DH0обр — 74,0 кДж/моль; р-римость водорода в ниобии меняется от 104 см3/г при 20 °С до 4,0 см3/г при 900 °С, выше 1000 °С Н2 практически не раств. в ниобии. Гидриды образуются также на первых стадиях растворения ниобия во фтористоводородной к-те, ее смеси с HNO3 и расплаве NH4HF2, а также при электролизе к-т с катодом из ниобия (таким путем получен NbH2,00). Гидрирование ниобия и дегидрирование при нагр. используют для получения мелкодисперсного металла.
При взаимодействии ниобия с С образуется одна из трех фаз: твердый р-р С в металле, Nb2C или NbC. Твердый р-р содержит 2 ат. % С при 2000 °С; р-римость С в ниобии резко падает с понижением т-ры. К а р б и д Nb2C образует три полиморфные модификации: до 1230 °С устойчива ромбич. a-фаза (пространств. группа Pbcn), при 1230°С она превращ. в гексагoн. b-фазу (пространств. группа Р6322), к-рая при 2450 °С переходит в др. гексагoн. -g-фазу (пространств. группа P63/mmc); т. пл. ок. 2990 °С (инконгруэнтно, с выделением твердого NbСx). Для a-Nb2C: C0p 63,51 Дж/(моль.К); DH0обр - 188 кДж/моль; S0298 64,10 ДжДмоль.К); т-ра перехода в сверхпроводящее состояние 9,2 К. Карбид NbC-кристаллы серого или серо-коричневого цвета, область гомогенности от NbC0,70 до NbC1,0; при 377 °С наблюдается полиморфный переход, высокотемпературная кубич. фаза (а = 0,4458 нм, пространств. группа Рт3т, плотн. 7,81 г/см3) инконгруэнтно плавится ок. 3390 °С; DH0обр- 135 кДж/моль; S0298 35,4 ДжДмоль•К); т-ра перехода в сверхпроводящее состояние 12,1 К. Фаза NbC0,80 имеет т. пл. ~ 3620 °С. NbC образует твердые р-ры с ТаС, TiC, ZrC и др. В пром-сти NbC получают взаимод. Nb2O5 с сажей ок. 1800 °С в атмосфере Н2; м.б. также получен из элементов или нагреванием летучих галогенидов ниобия в атмосфере углеводородов до 2300-2900 °С.
В системе Nb-N образуются: твердый р-р внедрения азота в ниобии (a-фаза), н и т р и д ы Nb2N (гексагон. р-фа-за) и NbN (кубич. d- и гексагон. q-фазы) и еще неск. фаз. Р-римость N2 в ниобии при атм. давлении описывается ур-нием с = 180ехр(- 57300/RT) ат. % (1073 <= T<= 1873 К). b-Фаза гомогенна в области NbN0,4-NbN0,5; для нее а = 0,3056 нм с = 0,4995 нм, пространств. группа Р63/ттс- С0p 67 ДжДмоль.К); DH0обр - 249 кДж/моль; S0298 79 ДжДмоль.К). Светло-серая с желтоватым блеском d-фаза гомогенна в области NbN0,88-NbNl,06, для нее а = 0,4373-0,4397 нм, пространств. группа Fm3m. Для q-фа-зы: С0р 37,5 ДжДмоль.К), DH0oбр -234 кДж/моль, S0298 33,3 ДжДмоль•К). Нитриды не раств. в соляной к-те, HNO3 и H2SO4, при кипячении со щелочами выделяют NH3, при нагр. на воздухе окисляются. Т-ры перехода в сверхпроводящее состояние для NbNx с x = 0,80, 0,90, 0,93 и 1,00 равны соотв. 13,8, 16,0, 16,3 и 16,05 К. Нитриды получают нагреванием металла или гидрида ниобия в атмосфере N2 или NH3 до 1100-1800 °С или взаимод. летучих галогенидов ниобия с NH3. Известны карбо- (получают взаимод. Nb, N2 или NH3 с углеводородами выше 1200°С) и оксинитриды ниобия.
С фосфором ниобий образует ф о с ф и д ы NbP и NbP2, с As-а р с е н и д ы NbAs и NbAs2, с Sb-а н т и м о н и д ы Nb3Sb, Nb5Sb4, NbSb2, с S-с у л ь ф и д ы NbS3, NbS2 и NbS. С т а н-н и д Nb3Sn (т.пл. ~2130°С) и г е р м а н и д Nb3Ge (т. пл. ~ 1970 °С)- сверхпроводники с т-рами перехода в сверхпроводящее состояние соотв. 18,05 К и 23,2 К; получают их из простых в-в.
Ниобий образует бесцв. с у л ь ф а т ы. Nb2O4SO4-кристаллы с плотн. 3,6 г/см3; при 600-650 °С разлагается до Nb2O5; получают взаимод. Nb2O5 с 92,5%-ной H2SO4 в запаянных сосудах при 250-300 °С. Nb2O3(SO4)2-кристаллы с тетрагон. решеткой (а = 1,50 нм, с = 1,40 нм, z = 16, плотн. 3,42 г/см3); при нагр. разлагается до Nb2O4SO4; раств. в воде, причем р-римость растет с увеличением концентрации H2SO4 и достигает 4,60% по массе (в расчете на Nb2O5) при 20 °С и концентрации SO3 76,68% по массе; получают нагреванием Nb2O5 с избытком конц. H2SO4 до 300-350 °С.
См. также Ниобаты, Ниобийорганические соединения.
Получение. Ок. 95% ниобия получают из пирохлоровых, тан-талит-колумбитовых и лопаритовых руд. Руды обогащают гравитац. методами и флотацией, а также электромагн. или радиометрич. сепарацией, выделяя пирохлоровые и колум-битовые концентраты с содержанием Nb2O5 до 60%.
Концентраты перерабатывают до феррониобия или техн. Nb2O5, реже-до NbCl5 и K2NbF7 (см. Ниобия галогениды). Металлический ниобий получают из Nb2O5, K2NbF7 или NbCl5.
При произ-ве феррониобия смесь пирохлоровых концентратов с гематитом Fe2O3, порошкообразным Аl и добавками флюса загружают в вертикальные водоохлаждаемые стальные или медные реакторы и с помощью спец. запала инициируют экзотермич. р-ции: 3Nb2O5 + 10Al 6Nb + + 5Аl2О3; Fe2O3 + 2Аl
6Nb + + 5Аl2О3; Fe2O3 + 2Аl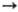 2Fe + Al2O3. Затем сливают шлак, охлаждают и измельчают полученный сплав. Выход ниобия в слиток при массе загрузки концентрата до 18 т достигает 98%.
2Fe + Al2O3. Затем сливают шлак, охлаждают и измельчают полученный сплав. Выход ниобия в слиток при массе загрузки концентрата до 18 т достигает 98%.
Техн. Nb2O5 получают выщелачиванием Nb и Та из концентратов и шлаков оловянной плавки действием фтористоводородной к-ты с послед. очисткой и разделением Nb и Та экстракцией 100%-ным трибутилфосфатом, циклогекса-ноном, метилизобутилкетоном (реже-др. экстрагентами), реэкстракцией ниобия действием водного р-ра NH4F, осаждением из реэкстракта гидроксида Nb, его сушкой и прокаливанием.
По сульфатному способу концентраты обрабатывают H2SO4 или ее смесью с (NH4)2SO4 при 150-300 °С, выщелачивают р-римые сульфаты водой, отделяют Nb и Та от Ti, разделяют и очищают Nb и Та экстракцией их фторидных или оксофторидных комплексов, выделяя затем Nb2O5.
Хлоридный способ предусматривает смешивание концентрата с коксом, брикетирование и хлорирование брикетов в шахтной печи при 700-800 °С или хлорирование непосредственно порошкообразного концентрата и кокса в солевом хлоридном расплаве на основе NaCl и КСl. Далее проводят отделение летучих хлоридов Nb и Та, их разделение и очистку ректификацией и раздельный гидролиз водой с прокаливанием осадка гидроксида ниобия. Иногда хлорируют феррониобий или отходы металла.
Восстанавливают Nb2O5 до металла алюмино- или карбо-термически либо нагреванием смеси Nb2O5 и NbC при 1800-1900 °С в вакууме. Применяют также натриетермич. восстановление K2NbF7, электролитич. восстановление Nb2O5 или K2NbF7 в расплаве K2NbF7 и хлоридов щелочных металлов. Особо чистый металл или покрытия из ниобия на др. металлах получают восстановлением NbCl5 водородом при т-рах выше 1000°С.
Порошкообразный ниобий брикетируют, спекают штабики и переплавляют их в вакууме в электродуговых или электроннолучевых печах. На начальных стадиях очистки применяют также электролиз с расходуемым электродом в расплаве KCl-NaCl.
Описаны способы переработки концентратов ниобия с использованием жидких и газообразных фторирующих реагентов.
Определение. Ниобий определяют гравиметрически с использованием в качестве осадителей таннина, купферона, 8-гидро-ксихинолина и др. с послед. прокаливанием до Nb2O5. Применяют также колориметрич. (с добавлением в исследуемый р-р Н2О2, KSCN или соляной к-ты), радиометрич. (по 95Nb) и разл. спектральные методы. Для перевода соединений ниобия в р-р используют фтористоводородную к-ту или сплавляют с NaHSO4 либо K2S2O7 (реже-с К2СО3, КОН), выщелачивая затем плав насыщ. р-ром (NH4)2C2O4 в 20%-ном р-ре винной к-ты. Др. элементы отделяют от ниобия осаждением их сульфидов при действии H2S или (NH4)2S; титан отделяют в виде титанилсалициловой к-ты или жидкостной экстракцией.
Применение. Ок. 40-50% производимого ниобия используют для микролегирования сталей (концентрация ниобия 0,05-0,10% по массе), 20-30%-при получении нержавеющих и жаростойких сталей (0,2-1,2% ниобия), 20-25%-при получении жаропрочных сплавов на основе Ni или Fe (1-5% ниобия), 1-3%-в виде металла и сплавов на основе ниобия. Ниобий и сплавы на его основе находят ограниченное применение в соплах ракет и ядерных реакторах. В электронике порошкообразный ниобий-заменитель Та в электролитич. конденсаторах. См. также Ниобия сплавы.
Карбид ниобия-промежут. продукт при получении ниобия или NbCl5, материал высокотемпературных нагревателей, в конструкциях высокотемпературных газоохлаждаемых ядерных реакторов, вместе с карбидами Та и Ti-компонент твердых сплавов на основе WC и Со. Нитрид NbN применяют для изготовления сверхпроводящих болометров, мишеней передающих телевизионных трубок. Карбонитрид NbC0,25N0,75 используют при изготовлении сверхпроводящих квантовых интерференц. устройств, высокочастотных резонаторов с высокими значениями добротности; перспективен для использования в магн. системах реакторов термоядерного синтеза. Металлиды Nb3Sn и Nb3Ge применяют при изготовлении соленоидов сверхпроводящих устройств; Nb3Ge перспективен для использования в магнитах МГД-генерато-ров и др. электротехн. устройств. См. также Лития ниобат.
Мировое произ-во (без СССР, 1980) ниобия в виде металла и сплавов ок. 15 тыс. т, в т.ч. 0,4 тыс. т-из шлаков оловянной плавки.
Ниобий открыл в 1801 Ч. Хатчет и назвал его "колумбием", заново ниобий открыт в 1845 Г. Розе. Идентичность Колумбия и ниобия была доказана позднее.
ПДК ниобия в воде 0,01 мг/л, для нитрида ниобия в воздухе рабочей зоны 10 мг/м3.
Лит.: Горощенко Я. Г., Химия ниобия и тантала, К., 1965; Киффер Р., Браун X., Ванадий, ниобий, тантал, пер. с нем., М., 1968; Фейрбротер Ф., Химия ниобия и тантала, пер. с англ., М., 1972; Берлин И. К., Вайсен-берг А. И., в кн.: Металлургия цветных и редких металлов, т. 10, М., 1977, с. 37 72; Патрикеев Ю. Б., Воробьева Н. С., Зайцев А. Б., "Цветная металлургия", 1985, № 3, с. 90-92; Gupta С. К., "International Metals Reviews", 1984, v. 29, № 6, p. 405-44. Э. Г. Раков, В. А. Мусорин.
